

| Москва 2002 |
Введение
Фуллерены — новая аллотропная модификация углерода: полые сфероидальные молекулы Cn, образующие молекулярные кристаллы. Открытые в 1985 г. и выделенные в макроскопических количествах в 1990 г., они до сих пор являются объектом интенсивного изучения. Получены и охарактеризованы различными физико-химическими методами многочисленные производные фуллеренов. Однако удельный вес структурных исследований среди всех статей по фуллереновой тематике до последнего времени был относительно малым.
Общее число фуллереновых структур, депонированных в Кембриджском банке структурных данных (КБСД), составляет 281 (исключая повторные исследования), в том числе: 246 производных C60, 35 производных C70, по два производных C76 и C80, и по одному производному C78, C82 и C84. В ряде случаев данные, депонированные в КБСД, не включают координаты атомов.
Кристаллы фуллеренов и их производных содержат много дефектов и часто бывают двойниковыми. Кроме того, достаточно большое количество структурно исследованных производных фуллеренов выявляют типичную для них проблему ротационной разупорядоченности. Ввиду квазисферической формы молекулы фуллерена, ее разные ориентации в кристалле близки по энергии. Их сосуществование приводит к ухудшению качества кристалла и получаемой от него дифракционной картины. В производных фуллерена добавляется проблема сокристаллизации различных трудноразделимых изомеров замещения, а в случае высших фуллеренов — наличие разных изомеров фуллеренового остова, которые статистически занимают эквивалентные позиции в кристаллической решетке, повышая разупорядоченность структуры. Проблема разупорядоченности особенно актуальна в случае ван-дер-ваальсовых комплексов, в которых молекулы фуллеренов химически не модифицированы.
Темой данной работы является рентгеноструктурное исследование молекулярных комплексов фуллеренов C60 и C70, систематизация информации по исследованию и моделированию структур соединений данного класса, а также установление новых структурно-химических закономерностей.
Проблема предсказания структуры кристалла на основании его состава является одной из самых сложных в теоретической химии и в общем случае не находит удовлетворительного решения даже на нынешнем уровне развития вычислительной техники. Применительно к исследованию молекулярных комплексов, задача дополнительно осложнена наличием в кристалле различных видов молекул, соотношение между которыми заранее неизвестно. Поэтому в данной области существенную роль играют модельные качественные и полуколичественные соображения, а также поиск эмпирических закономерностей на основе анализа имеющихся кристаллических структур. Сопоставление структурных характеристик исследованных нами соединений друг с другом и с литературными данными, таким образом, является существенной частью данной работы.
Литературный обзор
Молекулярная структура фуллеренов
Стабильность замкнутой молекулы C60, обладающей икосаэдрической симметрией, была независимо предсказана двумя группами теоретиков в 70-е гг. [1,2]. Молекула C60 была впервые зафиксирована в масс-спектрах при лазерном испарении графита [3]. Неравновесное охлаждение паров углерода приводит к образованию различных кластеров Cn, среди которых преобладает C60.
Разработанный позднее метод получения макроколичеств фуллеренов [4] основан на испарении графита в плазме электрической дуги с графитовыми электродами в инертной атмосфере (He или Ar при давлении 10–100 мм.рт.ст.). Образующаяся сажа содержит до 15–20% фуллеренов, которые далее экстрагируют и разделяют колоночной хроматографией. Среди получаемых этим способом фуллеренов преобладают C60 (85%) и C70 (14%), остальное составляют высшие фуллерены – C76, C84, C90 и т.д.
Молекулы фуллеренов представляют собой выпуклые полиэдры с атомами С в вершинах, имеющие только пяти- и шестиугольные грани, т.е. карбоциклы с минимальным стерическим напряжением. Из теоремы Эйлера следует, что в таком случае пятиугольников должно быть двенадцать, а число шестиугольников может быть любым 1. Простейшим «фуллереновым» полиэдром является пентагондодекаэдр, не имеющий шестичленных циклов. Соответствующий насыщенный углеводород (додекаэдран C20H20) был получен в 1980-е годы методами органической химии [5]. Безлигандный фуллерен C20, по-видимому, неустойчив ввиду слишком большого стерического напряжения в ненасыщенном углеродном каркасе. Кластеры C20 неустановленной геометрии были зафиксированы в газовой фазе при термическом разложении бромированного додекаэдрана [6]. Кристаллическая структура фуллерена C36, о выделении которого сообщалось в [7], не была определена. По-видимому, его кристалл состоит из ковалентно связанных друг с другом фрагментов C36, а не из отдельных молекул.
| Таблица 1. Количество «фуллереновых» полиэдров (M), удовлетворяющих правилу изолированных пятиугольников, в зависимости от числа атомов (n) в углеродном каркасе |
|||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | 60 | 62–68 | 70 | 72 | 74 | 76 | 78 | 80 | 82 | 84 | 86 | 90 | 96 |
| M | 1 | — | 1 | 1 | 1 | 2 | 5 | 7 | 9 | 24 | 35 | 46 | 187 |
Все структурно исследованные фуллерены удовлетворяют так называемому правилу изолированных пятиугольников (isolated pentagon rule, IPR [8]): два пятичленных цикла не должны иметь общих вершин. При условии соблюдения этого правила простейшим из фуллеренов является C60, называемый также бакминстерфуллереном (Рис. 1), следующим — C70, и далее существуют фуллерены с любым чётным числом атомов углерода. Правило изолированных пятиугольников кардинально ограничивает число возможных фуллереновых структур: так, запрещенный по IPR каркас C66 без учета этого правила имеет 4478 различных геометрических изомеров [9].
Начиная с C76, возможны различные изомеры углеродного каркаса, удовлетворяющие IPR (Табл. 1). Сравнительная стабильность различных фуллеренов широко исследована теоретически методами квантовой химии [10,11].
Самым распространенным из фуллеренов является C60, обладающий икосаэдрической симметрией (Ih). Его структура была впервые подтверждена спектром ЯМР 13C, состоящим из одного синглета [12]. В молекуле C60 все атомы эквивалентны (т.е. переводятся друг в друга операциями симметриии молекулы), однако существует два типа симметрически неэквивалентных связей: расположенные на стыке пятичленного и шестичленного и на стыке двух шестичленных циклов (так называемые связи 5/6 и 6/6, соответственно). Последняя связь имеет больший вклад π-составляющей и меньшую длину. Расстояния C-C в C60 по данным газовой электронографии (ГЭ) [13] равны 1.40 Å (6/6) и 1.46 Å (5/6); средние значения для упорядоченных молекулярных комплексов C60, рассчитанные по Кембриджскому банку структурных данных, составляют 1.39 (6/6) и 1.45 Å (5/6). Валентные углы в пятичленных циклах равны 108o, а в шестичленных — 120o. Сферический эксцесс φ, определяемый как дополнение суммы трёх валентных углов при данном атоме до 360o, в C60, следовательно, равен 12o для всех атомов.
Следующий по распространенности фуллерен C70 (Рис. 2), имеющий симметрию D5h, отличается от C60 дополнительным экваториальным поясом шестиугольников. В нем имеется 5 симметрически неэквивалентных атомов и 8 различных типов связей, что согласуется с данными ЯМР [14]. Длины связей в свободной молекуле были определены методом ГЭ [15]; при отнесении наблюденных длин к типам связей авторы опирались на результаты расчёта по методу функционала плотности. В Табл. 2 приведены длины связей в C70 по данным ГЭ, а также взятые из наиболее точной структуры молекулярного комплекса C70·6S8 [16], определённой методом рентгеноструктурного анализа монокристаллов (РСА). Экваториальная связь h типа 6/6 существенно превосходит по длине все остальные, приближаясь к одинарной алифатической связи углерод-углерод. Прочие связи типов 5/6 и 6/6 близки по длине и характеру к соответствующим связям в фуллерене C60. Сферический эксцесс максимален для атомов, расположенных на полюсах молекулы, и минимален для экваториальных.
|
Таблица 2. Длины связей в молекуле фуллерена C70 |
||||
|---|---|---|---|---|
| Связь | Тип | Кол-во | ГЭ [15] | РСА [16] |
| a | 5/6 | 10 | 1.46 | 1.45 |
| b | 6/6 | 10 | 1.39 | 1.38 |
| c | 5/6 | 20 | 1.45 | 1.45 |
| d | 6/6 | 10 | 1.39 | 1.37 |
| e | 5/6 | 20 | 1.47 | 1.45 |
| f | 5/6 | 10 | 1.42 | 1.43 |
| g | 6/6 | 20 | 1.40 | 1.41 |
| h | 6/6 | 5 | 1.54 | 1.47 |
Молекулярные структуры высших фуллеренов менее изучены. Выделенный в чистом виде C76 по данным РСА для комплекса с серой C76·6S8 [17] представлен хиральным изомером симметрии D2. Кристалл содержит рацемическую смесь энантиомеров, статистически занимающих одни и те же позиции.
По квантовохимическим данным [11], относительная устойчивость изомерных фуллереновых каркасов Cnq- может изменяться в зависимости от их заряда q (Рис. 3).
C78, по данным ЯМР, представлен смесью двух изомеров симметрии C2v и D3 в соотношении 5:1 [18]. Основной изомер фуллерена C80 имеет структуру с симметрией D2d [19]. Позднее был выделен также другой изомер симметрии D5h [20]. Икосаэдрический изомер C80 (Рис. 4), по квантовохимическим данным наименее устойчивый в свободном виде, был получен в форме эндоэдральных производных, стабилизированных переносом заряда с атома металла на углеродный каркас (см. § 2.9). В отличие от молекулы C60, где в каждом 6-членном цикле связи типа 6/6 и 5/6 альтернируют, молекула Ih-симметричного C80 содержит периленовые фрагменты из пяти конденсированных шестиугольников.
Исследование структуры высших фуллеренов C76 и C82 в виде сольватов с толуолом методом рентгеновской порошковой дифракции на синхротронном излучении (СИ) [21] не позволило достоверно определить геометрию их углеродных скелетов.
Чистый фуллерен C84, по данным ИК-спектроскопии [22], состоит из смеси двух основных изомеров симметрии D2d и D2. Его выделенный и структурно исследованный π-комплекс с платиной [23] содержит изомер симметрии D2d с примесью других неидентифицированных изомеров (см. § 2.8).
Спектр энергий молекулярных орбиталей C60 π-типа был впервые получен простым методом Хюккеля [2]. Ввиду высокой симметрии молекулы, её НСМО вырождена трёхкратно, а ВЗМО — пятикратно (см. Рис. 5а). Более низкосимметричная молекула C70 имеет лишь невырожденные и дважды вырожденные уровни (см. Рис. 5б). Разности энергий (НСМО-ВЗМО) в стабильных фуллеренах Cn, определённые из квантовохимических расчётов, в среднем уменьшаются с ростом n, стремясь в пределе к нулю (величине для графита) [24].
Таким образом, полиэдрические молекулы фуллеренов сохраняют такие существенные черты плоских сопряженных π-систем, как низкоэнергетическое π-связывание и стабилизация альтернантных структур. Вследствие этого энергетическая структура их граничных орбиталей может быть воспроизведена простым методом Хюккеля, а сами молекулы Cn проявляют такие свойства ненасыщенных углеводородов, как присоединение к «кратным» связям 6/6 и образование π-комплексов с металлами. Вместе с тем, химически не модифицированные углеродные каркасы фуллеренов не содержат полностью делокализованных π-систем ароматического типа, и кратные связи в них остаются частично локализованными.
Кристаллические структуры индивидуальных фуллеренов
Чистый кристаллический фуллерен C60, полученный пересублимацией в вакууме, имеет гранецентрированную кубическую (ГЦК) решётку [25]. При комнатной температуре молекулы в ней ротационно разупорядочены. При понижении температуры до 258К происходит фазовый переход, сопровождающийся частичным упорядочением молекул и понижением симметрии кубического кристалла с Fm3m до Pa3. При дальнейшем охлаждении динамическая разупорядоченность постепенно сменяется статической [26]. При еще более низких температурах кристалл содержит статистическую смесь молекул в двух ориентациях (по данным нейтронографии при 5К [27]), однако полного вымораживания данной степени свободы не наблюдалось. В специальных условиях удаётся получить кристаллический порошок метастабильной гексагональной модификации C60, в которой молекулы уложены по типу двухслойной плотнейшей шаровой упаковки [28]. Раннее сообщение о другой гексагональной модификации фуллерена с параметрами a=33.54 Å, c=10.11 Å [29], не подтвердилось. По-видимому, данные параметры соответствуют не чистому фуллерену, а некоторому сольвату с малым содержанием растворителя.
Более сложным температурным поведением обладает фуллерен C70, молекула которого по форме близка к вытянутому эллипсоиду вращения. От высокотемпературной ГЦК-фазы, характеризующейся изотропным вращением молекулы, он при понижении температуры до 340 К переходит к тригональной (ромбоэдрической) фазе, в которой длинные оси молекул фиксированы вдоль оси 3 и вращение происходит только вокруг них (Рис. 6). При более низкой температуре (280 К) молекулы окончательно упорядочиваются, понижая симметрию. Образуется моноклинная фаза, по параметрам ячейки близкая к тригональной (a ≈ c, β ≈ 120o). Как и в случае C60, имеется метастабильная модификация C70 с гексагональной плотнейшей упаковкой (ГПУ) сферически разупорядоченных молекул. При понижении температуры она претерпевает два аналогичных фазовых перехода с упорядочением вращения. Между высокотемпературными ГЦК- и ГПУ-модификациями существует область промежуточных фаз с нерегулярным наложением слоев [30].
Для некоторых высших фуллеренов, молекулы которых более близки к сферической форме, зафиксирована только высокотемпературная ГЦК-форма. Детали их поведения при низких температурах не исследованы [31]. В случае C84 зафиксированы два фазовых перехода при температурах 181 и 235 K, однако строение низкотемпературных фаз неизвестно [32].
Фуллерены способны образовывать соединения с металлами, в которых углеродный кластер является анионом. Свойства фуллерид-анионов в растворе и в конденсированном состоянии обсуждены в обзоре [33]. Цикловольтамперометрия показывает, что бакминстерфуллерен в растворе способен обратимо восстанавливаться до моно-, ди- и трианиона. Поскольку НСМО фуллерена трёхкратно вырождена, они содержат, соответственно, один, два и три неспаренных электрона и дают характерные сигналы ЭПР. В апротонных средах возможно восстановление C60 до диамагнитного гексааниона [34].
Взаимодействие твёрдого бакминстерфуллерена с щелочными металлами позволяет получить кристаллические фуллериды. Заполнение октаэдрических, а затем и тетраэдрических пустот в ГЦК упаковке углеродных сфер атомами щелочных металлов приводит соответственно к солям типа MC60 и M3C60 [35,36]. Дальнейшее допирование сопровождается перестройкой всей структуры. Конечным его продуктом является соль M6C60 [37], в которой фуллереновые сферы упакованы по объёмноцентрированному кубическому (ОЦК) типу, а в центрах граней расположены ромбы из четырёх катионов металла (Рис. 7). Существует также промежуточная фаза состава M4C60 с аналогичной упаковкой молекул фуллерена, где в части пустот содержится не по 4, а по 2 атома металла, и симметрия понижена до орторомбической [38]. В случае лития возможно дальнейшее допирование, приводящее к продукту состава C60Li15 с ГЦК-упаковкой остовов фуллерена [39].
Соли щелочных металлов с трёхзарядным анионом бакминстерфуллерена, НСМО которого заполнена наполовину, при комнатной температуре являются проводниками, а при низких температурах (18 K для калиевой соли) переходят в сверхпроводящее состояние [40]. Путём варьирования металлической компоненты была выявлена положительная корреляция критической температуры с параметром кубической кристаллической решётки [41]. Для соли CsxRb3-xC60 было получено значение TC=33 K [42], а допирование смесью рубидия и таллия привело к максимальной для фуллереновых производных величине TC=45 K [43]. В [44] и других работах тех же авторов сообщалось о значительно более высоких критических температурах, достигнутых в случае дырочно-допированного C60 и его сольватов. Эти данные, однако, не подтвердились и в настоящее время считаются некорректными. Калориметрическое исследование солей типа M3C60 показывает, что ориентационный фазовый переход, характерный для чистого C60, в них сохраняется, но происходит при более высоких температурах (299 К для Na2CsC60, 313 K для Na2RbC60 и 305 К для Na2KC60) [45].
Фуллериды состава KCsBaC60 и KBa2C60 с аналогичной структурой, но более высоким зарядом аниона, являются относительно плохими проводниками металлического типа. Сверхпроводимости в них не обнаружено [46].
Слои, содержащие гексаанион фуллерена C606-, являются диэлектриками. Замена части катионов на двухзарядные (K3Ba3C60) и повышение формального заряда фуллеренового остова до 9 приводит опять к электропроводящей фазе. У неё также была обнаружена сверхпроводимость, однако при более низкой температуре (5 K) [47].
Фуллериды кальция Ca5C60 [48] и бария Ba6C60 [49] структурно аналогичны солям типа M6C60 (в случае кальциевой соли часть позиций металла вакантна), но являются проводниками и обладают сверхпроводимостью с критической температурой 4–8K.
Структура фуллерида иттербия состава Yb2.75C60 может быть описана как аналог K3C60, в котором 1/8 всех октаэдрических пустот вакантна, катионы смещены из центров пустот. В связи с упорядочением вакансий все ребра исходной кубической ячейки удвоены и симметрия решётки понижена до орторомбической [50]. Исследования систем C60-Eu [51] и C60-Sm [52] показали наличие аналогичных фуллеридов, а также фазы состава M6C60 со структурой K6C60.
Палладий и платина образуют с бакминстерфуллереном кристаллические соединения переменного состава C60Mx, 1 ≤ x ≤ 7, в которых металл, по-видимому координирован двойными связями молекулы фуллерена в формально нульвалентный комплекс [53,54]. Эта структурная модель не подтверждена дифракционными методами, однако она согласуется с данными EXAFS для Pd-производных [55] и хорошо объясняет превращение фуллеридов Pd и Pt в π-комплексы с η2-C60-лигандом при действии фосфинов [56].
Фуллерен C70 образует со щелочными металлами ряд фуллеридов с составами MC70, M4C70 и M6C70 [57]. ГЦК-фаза M3C70 со щелочными металлами устойчива лишь при повышенной температуре, а при охлаждении либо переходит в тригональную фазу, либо диспропорционирует. Однако она может быть стабилизирована подбором катионов подходящего размера (Na2CsC70) [58]. Получена также ГЦК-фаза состава Ba3C70 [59]. Поскольку НСМО молекулы C70 вырождена однократно, а следующая по энергии орбиталь — двукратно (см. Рис. 5), тетраанион C704- имеет наполовину заполненную ВЗМО. В солях состава M4C70, как и в M3C60, была обнаружена сверхпроводимость.
Фуллериды на основе высших фуллеренов менее исследованы. Предельным продуктом допирования C84 является соль состава K8+xC84, аналогичная по структуре K6C60 и содержащая упорядоченные молекулы фуллерена. Известен также фуллерид с меньшим содержанием металла, K3C84, в котором позиции атомов калия заняты частично и молекулы фуллерена разупорядочены [60].
В ионных соединениях фуллеренов с крупными неорганическими или органическими катионами упаковка углеродных кластеров отличается от плотной и подчиняется тем же закономерностям, что и в молекулярных комплексах, рассмотренных ниже (см. § 2.5).
Олигомеры и полимеры фуллеренов
Наличие двойных связей позволяет молекулам фуллеренов образовывать олигомеры и полимеры под действием излучения, давления, нагревания и различных химических инициаторов радикального или анионного характера. Превращения фуллеренов в условиях высокого давления описаны в обзоре [61].
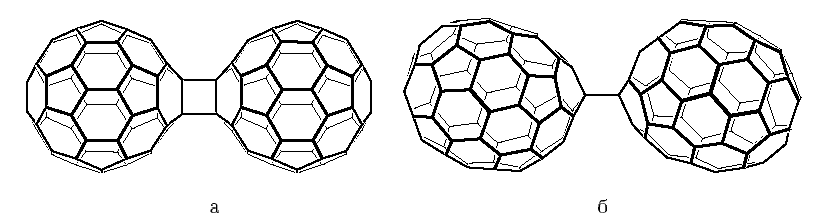
Чистый бакминстерфуллерен в условиях анионного катализа образует димер [62]. Методом РСА показано, что димер C120 является продуктом [2+2] циклоприсоединения по связям 6/6 (Рис. 8а). В образующемся четырёхчленном цикле из sp3-атомов C (сферический эксцесс 26.2–26.7o) связи 6/6 в фуллереновых остовах удлинены до 1.581 Å, а экзополиэдрические связи C-C имеют длину 1.575 Å. Были получены также несколько различных изомерных тримеров C60, зафиксированных методами масс-спектроскопии и электронной микроскопии высокого разрешения, однако выделить эти вещества в индивидуальном состоянии пока не удалось [63]. Описан другой способ синтеза димера C60: под давлением (5 ГПа) из молекулярного комплекса (ET)2C60 (ET=бис(этилендитио)тетратиафульвален), в котором молекулы фуллерена ориентированы связями 6/6 друг к другу [64].
Путём механохимической реакции получен кросс-димер C60 и
C70 [66], структура которого не исследована. По данным
квантовохимических расчётов, он также представляет собой продукт [2+2] присоединения, причем
фрагмент C70 присоединен по связи 6/6 типа «b» (см. Рис. 2).
Под давлением C60 даёт различные полимерные фазы. Некоторые из них
были получены в виде монокристаллов и исследованы методом РСА. В
ромбоэдрической фазе [67], полученной под давлением 5 ГПа,
обнаружены гексагональные слои молекул фуллерена, сшитые ковалентными
связями.
Описана также фаза, содержащая квадратные слои молекул фуллерена [68].
В фазе более высокого давления (13 ГПа), по данным порошковой
рентгеновской дифракции (рентгенофазового анализа, РФА), фуллерены связаны в трёхмерную сетку [69].
При давлении 8 ГПа и температуре 800–900oC полимеризация молекул
C60 и C70 сопровождается частичным разрушением
углеродных кластеров и образованием аморфных углеродных материалов;
некоторые из них приближаются по твёрдости к алмазу [69,70].
Более легко проходит полимеризация фуллереновых анионов. Так,
соль Na2CsC60 с кубической структурой при 0.7 ГПа образует линейный
полимер [71].
Соли щелочных металлов типа MC60, в которых при комнатной температуре
анионы ротационно разупорядочены, при понижении температуры образуют полимер,
в котором фрагменты C60 связаны в бесконечные цепочки одинарными связями
C-C [72].
Структура ион-радикальной соли Tol2Cr+·C60-·CS2
представляет собой аналогичный полимер с межмолекулярным
контактом C-C длиной 2.24 Å [73].
Другая соль состава Cp*2Cr·C60·(C6H4Cl2)2
(Cp*=C5Me5) при комнатной температуре содержит димеры (C60)22-,
соединённые одной связью длиной 1.60 Å [74].
Фуллерен C70 также способен полимеризоваться.
Так, в ион-радикальной соли Cs2(C70)2·CTV·(DMF)5·C6H6
2 моноанион фуллерена существует в виде
димера (C70-)2.
В несимметрично искаженной структуре остова C70 5-атомная грань
«полюса» молекулы приобретает геометрию конверта с атомом C(sp3)
в вершине (Рис. 8б). Два фуллереновых фрагмента
соединены одной связью длиной 1.56–1.58 Å, образованной атомами типа 1 [65].
Анионы C702- в соединениях типа AC70·nNH3 (A =
Ca, Sr, Ba, Eu, Yb) объединены в бесконечные цепочки
экзополиэдрическими связями [75].
2CTV — циклотривератрилен
Обширный класс производных фуллерена составляют молекулярные комплексы с неполярными молекулами, также называемые в литературе смешанными или ван-дер-ваальсовыми кристаллами. Как было впервые показано Китайгородским [76], в кристаллах, удерживаемых только ван-дер-ваальсовыми силами, наиболее энергетически выгодная упаковка молекул обычно совпадает с наиболее плотной. Поскольку сфероидальные молекулы Cn не могут сформировать упаковку без пустот значительного размера, фуллерены легко образуют молекулярные комплексы (клатраты, соединения включения) со многими молекулами — «гостями». Структура и свойства таких соединений рассмотрены в обзорах [56,77,78].
Пустоты исходной плотнейшей упаковки фуллеренов способны вместить лишь отдельные атомы — например, щелочного металла (см. § 2.3). В подавляющем большинстве кристаллических молекулярных комплексов фуллеренов присутствуют менее плотные структурные мотивы из сфероидов Cn, характеризуемые «парциальным» молекулярным координационным числом (МКЧ). Другой характеристикой плотности кладки молекул фуллерена может служить введенный в [79] параметр разбавления: ρ = (Vcell-Vfull)/Vfull, где Vcell — объём элементарной ячейки, а Vfull — объём, занимаемый в ней молекулами фуллерена. Параметр разбавления, принимающий значения от 0.33 (ГЦК) и выше, связан с обычным парциальным коэффициентом упаковки фуллереновых сфер в кристалле κ = Vfull/Vcell простым соотношением 1/κ = ρ+1.
Поскольку молекулы в данном типе соединений удерживаются вместе неспецифическими ван-дер-ваальсовыми взаимодействиями, многие молекулы-«гости», близкие друг к другу по размерам и форме ван-дер-ваальсовой поверхности, в комплексах с фуллеренами образуют подобные структурные мотивы с близкими значениями параметра ρ. При этом их кристаллы могут относиться к различным сингониям и сильно различаться по параметрам элементарных ячеек. Мотив размещения фуллереновых молекул в таких структурах играет роль лабильной ван-дер-ваальсовой матрицы, позволяя их классифицировать по значениям МКЧ и ρ.
В качестве «гостя» часто выступают молекулы растворителя. При выращивании кристаллов фуллеренов из растворов в большинстве случаев образуются кристаллосольваты. Так, бакминстерфуллерен образует большую серию сольватов и молекулярных комплексов C60·2A, (где A=P4 [80], CCl4 [81] и др.) с плотными гексагональными слоями из фуллереновых молекул и молекулами «гостя» A в межслоевом пространстве, характеризуемые значениями МКЧ = 6–8 и ρ = 0.7–0.8 (Рис. 9). В то же время некоторые органические молекулы (например, м-ксилол [82]) образуют сольваты состава 3C60·2A, которые отвечают ГПУ-мотиву из фуллереновых сфер с «вырезанными» колонками (МКЧ=9–10) и размещением молекул растворителя в получившихся каналах (Рис. 9). Некоторые растворители способны образовывать с фуллереном несколько сольватов различного состава (например, в случае CCl4 — 1:2 [81] и 1:13 [83]).
Бакминстерфуллерен относительно хорошо растворяется в ароматических углеводородах и их неполярных производных, но практически не растворяется в полярных жидкостях (спиртах, эфирах и др.) [84]. Плохими растворителями являются алифатические углеводороды, которые, однако, также образуют сольваты. При достижении определённой температуры (T*) сольваты претерпевают инконгруэнтное плавление и разлагаются на фуллерен и растворитель. Для ароматических растворителей, как правило, T* ниже точки кипения. Вследствие отрицательной энтальпии образования сольвата по отношению к фуллерену и растворителю в области стабильности сольвата растворимость фуллерена обычно растет с повышением температуры, а при T=T* на кривой температурной зависимости растворимости наблюдается излом, иногда являющийся максимумом. Подобное явление получило название «аномальной температурной зависимости» [84], хотя аналогичное поведение растворимости встречалось ранее — например, для системы Na2SO4 — H2O. Высшие фуллерены ведут себя в общем аналогично C60; растворимость C70 обычно немного выше растворимости C60 [85].
Основные структурные мотивы (Cn)m, встречающиеся в исследованных молекулярных комплексах фуллеренов, перечислены в Табл. 3. Для всех структур приведено МКЧ молекулы фуллерена. Мотивы упаковки «фуллерен-гость» схематично изображены на Рис. 9.
Среди трёхмерных каркасов часто встречается структура, представленная серией сольватов с пентаном, гексаном, дихлорэтаном и трихлорэтиленом состава 1:1 и имеющая следующую упаковку молекул: тетрагональные плотные слои сдвигаются так, что плотнейшие наложения слоев, в которых каждая молекула одного слоя имеет четырёх ближайших соседей в другом слое, чередуются с наложениями другого типа, в которых число таких соседей равно двум и между слоями остаются пустоты (Рис. 10). Для всех этих сольватов отмечено образование характерных полисинтетических двойников, обладающих приближенной осевой симметрией 10-го порядка [86]. Более крупные молекулы фуллеренов C82 и M@C82 образуют сольват того же структурного типа с толуолом [21,87].
| Таблица 3. Структурные мотивы из молекул фуллеренов в их молекулярных комплексах |
|||
|---|---|---|---|
| Тип | МКЧ | Пример | Ссылка |
| «Почти плотные» трёхмерные каркасы | 9–11 | C60·2/3C8H10, C60·C5H12 | [82], [88] |
| Гексагональные слои с тригонально-призматическими пустотами между слоями | 6–8 | C60·2P4 | [80] |
| Ажурные трёхмерные упаковки (трёхмерные соты с каналами или алмазоподобные каркасы) | 4–6 | C60·4C6H6 | [89] |
| Пространственно разделённые плотные слои | 4–6 | C70·6S8 | [16] |
| Разреженные слои, в том числе графитоподобные | 3–6 | C60·OEPPd·1.5(C6H6) | [90] |
| Колоночные мотивы | 2–4 | C70·OEPCo·CHCl3·C6H6 | [91] |
| Островные мотивы | 0–1 | Cn·13C6H12 (n = 60, 70) | [83] |
Разреженные (приближенные к квадратным с МКЧ=4) слои встречаются, например, в молекулярном комплексе бакминстерфуллерена с тетраметилтетраселенафульваленом состава C60·C10H12Se4·2(CS2) [92]. Графитоподобный слой с МКЧ=3 имеется в соединении C60·OEPPd·1.5(C6H6)3 [90]. Примером колоночных мотивов может служить комплекс с бис(этилендитио)тетратиафульваленом C60·2(C10 H8 S8) [93].
Островные упаковки образуются в комплексах с объёмистой нефуллереновой компонентой, которая изолирует молекулы фуллерена друг от друга. В их кристаллах взаимодействия молекул фуллерена друг с другом не являются главным фактором, определяющим структуру. Примером таких соединений являются кубические сольваты состава C60·13(solv), образуемые им с циклогексаном и CCl4 [83].
Ряд молекулярных комплексов может быть получен путём интеркалирования малых молекул в твёрдый фуллерен под давлением. Так, в работе [94] методом ЯМР зафиксировано вхождение молекул кислорода в октаэдрические полости ГЦК-упаковки фуллерена при комнатной температуре под давлением 1 кбар. Основной путь получения молекулярных комплексов — сокристаллизация компонентов из подходящего растворителя. Вхождение тетраэдрических молекул P4 из раствора белого фосфора даёт комплекс C60·2P4 (ρ = 0.82) с плотными гексагональными слоями молекул фуллерена (см. выше), тогда как более крупные молекулы серы образуют комплекс C60·2S8 [95] (ρ = 1.08), содержащий трёхмерный фуллереновый каркас с каналами. В то же время C70 образует с серой комплекс состава 1:6 (ρ = 2.13) [16], в котором колонки из молекул C70 разделены слоями молекул серы. Последний структурный мотив обнаружен также в кристалле C76·6S8 [17] (см. § 2.1). Во всех комплексах с серой имеются короткие контакты C···S длиной 3.20 —3.50 Å, стабилизирующие кристалл.
Фуллерен способен образовывать комплексы с неорганическими соединениями. В случае молекулярных неорганических «гостей» такие соединения имеют обычную ван-дер-ваальсову природу. К таким комплексам относятся, например, C60·3TiCl4, в котором упаковка молекул представляет собой алмазоподобный каркас [96], и C60·3(C6H6)·2(Pd6Cl12) с колоночной упаковкой разупорядоченных молекул фуллерена [97]. Существуют также соединения, в которых нейтральная молекула фуллерена присутствует наряду с компонентами ионных солей, например C60·5(Ag+ NO3-) [98] с деформированной простой кубической кладкой фуллереновых сфер.
Среди больших донорных молекул, образующих молекулярные комплексы с фуллеренами, следует отметить производные тетрахалькогенафульваленов, полиарильные и конденсированные ароматические углеводороды, макроциклические тетраазосоединения и их комплексы с металлами, а также большие каркасные молекулы (каликсарены, циклодекстрины) с полостью, подходящей по размерам к фуллереновой сфере. Несовпадение размеров полости и «гостя» в соединениях последнего типа усиливает разупорядоченность, дополнительно снижая точность определения структуры.
Замещенные производные тетратиафульвалена (TTF) часто применяются в качестве катионных компонент ион-радикальных солей, анионами в которых служат ароматические молекулы с сильными электрофильными заместителями. Плоская геометрия катиона и аниона позволяет им укладываться в стопки, связанные ван-дер-ваальсовым стэкинг-взаимодействием.
Анализ структурных данных для молекулярных комплексов TTF, содержащихся в КБСД (более 300 структур) показывает, что молекулы производных TTF с объёмистыми заместителями или в комплексах с крупными неплоскими молекулами нередко изогнуты. В частности, так происходит почти во всех комплексах тетрахалькогенафульваленов с фуллеренами, где небольшой изгиб обеспечивает более плотное прилегание к сфероидальной молекуле Cn (Рис. 11). Заметное исключение — комплекс C60·(BEDT-TTF+I3-)4, где плоский фульвален присутствует в виде катион-радикала [99]. Допирование щелочными металлами (K, Rb) молекулярного комплекса OMTTF·C60·C6H65 приводит к сверхпроводящим фазам с относительно высокой Tc (17 K в случае калия и 23 K в случае рубидия) [100].
Конденсированные ароматические углеводороды и полиарены, подходящие по форме к молекуле фуллерена, также могут образовывать с ним молекулярные комплексы. Примером является диантрацен [101], входящий в комплекс C60·C28H20·3(C6H6).
Координационные соединения металлов с макроциклическими тетрааза-лигандами содержат атом металла в плоскоквадратном координационном окружении, склонный к дополнительному связыванию. Эти комплексы часто рассматриваются в качестве супрамолекулярных агентов, способных зафиксировать молекулу фуллерена в одной ориентации, уменьшив ротационную разупорядоченность структуры. Так, молекула-«клетка», содержащая два цинк-порфиринатных фрагмента, соединённых по парациклофановому типу, образует с фуллереном C60 прочный комплекс состава 1:1 (структурно не исследованный), устойчивый в растворе [102]. В исследованных комплексах с порфиринатами имеются примеры как упорядоченных, так и разупорядоченных молекул фуллеренов. Часто встречается структурный мотив, в котором молекулы фуллерена и порфирина чередуются в зигзагообразных цепочках (Рис. 12).
Известен ряд молекулярных комплексов фуллеренов с цикловератриленом и каликсаренами. В некоторых из них присутствует кристаллизационная вода или спирт, что нехарактерно для других фуллереновых производных, как правило, гидрофобных. Фуллереновая сфера в таких соединениях укладывается в чашеобразную органическую молекулу. Циклодекстрин, хорошо растворимый в воде, образует комплекс с фуллереном и таким образом позволяет перевести фуллерен в водный раствор в концентрации до 10-5М. Кристаллическая структура этого комплекса не изучена [103].
Структурные мотивы (Cn)m в молекулярных комплексах фуллеренов и их химически модифицированных производных близки и могут рассматриваться вместе. Гистограмма распределения параметра разбавления для всех структурно исследованных производных фуллеренов (Рис. 13) содержит два максимума, отвечающих значениям ρ = 0.8 и ρ = 2.0. Первое значение типично для слоистых гексагональных упаковок, а второе — для ажурных каркасов. Значения ρ ≥ 3 отвечают, как правило, колоночным и изолированным мотивам.
Распределение по МКЧ (Рис. 14) всех фуллереновых структур, депонированных в КБСД, показывает характеристичность разреженных структурных мотивов и постепенное уменьшение числа упаковок с ростом МКЧ ≥ 6 на фоне сильного преобладания чётных молекулярных координационных чисел над нечётными. Последнее, видимо, объясняется наличием преимущественно центросимметричных мотивов из углеродных сфер.
Часто встречающаяся разупорядоченность молекул фуллерена снижает качество дифракционных данных. В некоторых случаях её удаётся аппроксимировать совмещением двух молекул фуллерена в разной ориентации с частичной заселённостью соответствующих атомных позиций (и наложением некоторых атомов, принадлежащих к разным ориентациям). Для уменьшения корреляций атомных параметров в уточнении по методу наименьших квадратов ротационно разупорядоченные структуры нередко уточняют с фиксированной геометрией молекулы фуллерена. В случае C60 наиболее часто встречаются два основных типа разупорядоченности (Рис. 15): две ориентации, связанные поворотом на 90o относительно оси симметрии второго порядка (а), и две ориентации, связанные поворотом на 60o относительно оси симметрии третьего порядка (б). В первом варианте 48 пар близко расположенных атомов C из разных ориентаций задают общими позициями, а разупорядоченная часть молекулы, т.е. пространственно разделённые атомные позиции с частичной заселённостью, образует характерные «кресты», расположенные по вершинам октаэдра на фуллереновой сфере. Во втором типе разупорядочения у молекулы C60 имеются упорядоченные «полюса» и разупорядоченный экваториальный пояс. Для молекулы C70 не выявлено подобных типов регулярного наложения ориентаций, и разупорядоченные структуры, как правило, аппроксимируются наложением двух молекул с фиксированной геометрией без общих атомных позиций.
В ряде молекулярных комплексов фуллерена компонента «гостя» также разупорядочена, что дополнительно снижает точность РСА фуллереновых производных. На Рис. 16 показано распределение исследованных структур производных фуллеренов по значению R-фактора. Видно, что распределение имеет характерный «хвост» в области R ≥ 10%, составленный в основном из сильно разупорядоченных структур.
В некоторых молекулярных комплексах, как и в чистом фуллерене, происходят фазовые переходы второго рода «порядок-беспорядок». Один из наиболее сложных примеров температурной зависимости был обнаружен у комплекса с бифенилом состава C60·(C6H5)2 [104], в котором разупорядочены молекулы как фуллерена, так и бифенила. При понижении температуры происходят два фазовых перехода с упорядочением обеих компонент кристалла: 212 К (бифенил) и 147 K (фуллерен).
Отдельную группу соединений, кристаллохимически близких к молекулярным комплексам, составяют фуллеренсодержащие ионные соли с крупными ионами. Имеются примеры таких соединений, в которых фуллерен присутствует как в нейтральном (например, C60·BEDT-TTF+I3- [99]), так и в ионном виде (например, соль C60-·2Ph4P+·Cl- [105]). Противоион может быть не только органическим, но и металлосодержащим, как в серии изоморфных сольватированных аммиаком солей C602-·M(NH3)62+·6(NH3) (M=Mn, Cd [106], Co, Zn [107], Ni [108]), содержащих плоские квадратные слои фуллерид-дианионов и катионы амминокомплексов с октаэдрической координацией металла. Исследованы также сольват фуллерида калия с тетрагидрофураном C603-K+3·14THF [109] и фуллерид 2,2,2-криптанда калия C602-(C18H36N2O6K+)2·4PhMe [110] (в обеих солях упаковка фуллереновых сфер островная).
Электростатическое взаимодействие с катионами делает упаковку фуллерид-анионов более плотной, чем в случае молекулярных комплексов, однако отрицательный заряд распределен по поверхности молекулы фуллерена и не препятствует её вращению. Поэтому среди анионных производных фуллерена также встречаются как упорядоченные, так и разупорядоченные структуры.
В ион-радикальной соли C60·TDAE6 был зафиксирован ферромагнетизм с Tc=16 K [111]. Некоторые другие аналогичные соли бакминстерфуллерена с донорными аминами, не охарактеризованные структурно, также проявляют различные типы ферромагнитного или антиферромагнитного упорядочения [78].
Фуллерид-анион с зарядом от -1 до -5 подвержен ян-теллеровскому искажению, нарушающему Ih-симметрию молекулы. Особенно выражен этот эффект в упорядоченной структуре C602-·2((Ph3P)2N+) [112].
В химических реакциях фуллерены проявляют себя как сопряженные полиалкены (см. § 2.1). Устойчивый фуллереновый остов в реакциях присоединения и замещения экзополиэдрических фрагментов можно рассматривать как большой псевдоатом. В этом разделе обсуждаются «бинарные» соединения фуллеренов CnXm, где X — внешние атомы, ковалентно связанные с фуллереновым ядром.
Структурное исследование смесей полиаддуктов CnXm затруднено большим количеством изомеров присоединения. Так, симметричное присоединение двух функциональных групп к одной из 30 эквивалентных связей типа 6/6 в бакминстерфуллерене делит остальные связи 6/6 на восемь неэквивалентных классов. Число теоретически допустимых изомеров стремительно растет с увеличением количества присоединённых групп (6·1014 для C60H36 [113]), делая невозможным их полный квантовохимический расчёт с поиском глобального минимума.
Оксиды C60 образуются в примесных количествах при контакте бакминстерфуллерена с воздухом. Для их целевого синтеза используется мета-хлорпероксобензойная кислота — стандартный реагент окисления алкенов в эпоксиды. Выделенные и структурно исследованные кристаллы монооксида C60O [114] и диоксида C60O2 [115] изоморфны чистому бакминстерфуллерену. Экзополиэдрические атомы кислорода, находящиеся в пустотах ГЦК-упаковки фуллереновых остовов, не выявлены из-за ротационной разупорядоченности. В C60O зафиксирован ориентационный фазовый переход при 278 K. РСА π-комплексов оксифуллеренов показал, что в молекуле (η2-C60O)Ir(Ph3P)2(CO)Cl атом кислорода присоединён к связи 6/6, а атом металла координирован другой связью 6/6 того же шестичленного цикла [116]. В C60O2-фрагменте молекулы (η2-C60O2)Ir(Ph3P)2(CO)Cl два атома кислорода присоединены к соседним связям 6/6; металлокомплекс содержит смесь изомерных продуктов координации металла по различным связям того же типа [117]. В монооксиде фуллерена C70, структурно исследованном в виде комплекса (η2-C70O)Ir(CO)Cl(PPh3)2 [118], атомы кислорода и иридия присоединены по соседним связям 6/6 типа b (см. Рис. 2).
Свойства гидридов фуллерена рассмотрены в обзоре [119]. Основным продуктом гидрирования бакминстерфуллерена является C60H36. ИК- и КР- спектры данного соединения в работе [120] проинтерпретированы в рамках предположения, что оно представляет собой смесь изомеров симметрии D3d и S6. Однако в [121] гидрид фуллерена с тем же составом по данным ЯМР спектров 1H, 13C и 3He для эндоэдрального соединения He@C60H36 описан как смесь изомеров симметрии C3 и C1, т.е. изоструктурен фториду C60F36 (см. ниже). Существует гидрид C60H18, также изоструктурный соответствующему фториду [122]. Их аналогия подтверждена 3He ЯМР спектрами фторидов и гидридов эндоэдрального соединения 3He@C60 [123]. Проведенное исследование C60H36 методом РФА показало элементарную ОЦК-ячейку [124].
Иод образует с C60 молекулярный комплекс C60·2I2 [125], принадлежащий к слоистому структурному типу (см. § 2.5), известен также иодсодержащий сольват C60·PhMe·I2 [126]. Остальные галогены вступают в реакцию присоединения к фуллереновому остову.
Известен ряд продуктов фторирования бакминстерфуллерена от C60F2 [127] до C60F48 [128], сохраняющих полиэдрический углеродный каркас. Методом РСА исследовано строение шести фторидных производных фуллерена: C60F18 [129], C60F18O [130], C60F17CF3 [131], двух изомеров C60F36 [132,133] и C60F48 [134,135]. Шлегелевские диаграммы структурно исследованных фторидов фуллерена приведены на Рис. 17, их молекулы показаны на Рис. 18, а геометрические параметры перечислены в Табл. 4.
| Таблица 4. Геометрические параметры структурно исследованных фторфуллеренов |
|||||||||
|---|---|---|---|---|---|---|---|---|---|
| Формула | Симм. | Связи C-C, Å | k* | R | Разуп. | Ссылка | |||
| sp3–sp3 | sp3–sp2 | Аром. | C=C | ||||||
| C60F18·PhMe | C3v | 1.54–1.67 | 1.47–1.53 | 1.37 | - | 0.74 | 0.049 | Нет | [129] |
| C60F36·1.75 PhMe | T | 1.55–1.66 | 1.48–1.49 | 1.36–1.38 | - | 0.70 | 0.090 | Да | [132] |
| C60F36·3.5 PhMe | C1 | 1.54–1.68 | 1.46–1.54 | 1.37–1.38 | 1.32 | 0.70 | 0.059 | Нет | [133] |
| C60F48·2C6H3Me3 | S6 | 1.54–1.61 | 1.49–1.58 | - | 1.29–1.30 | 0.71 | 0.051 | Да | [134] |
| *k — коэффициент упаковки молекул в кристалле по Китайгородскому [76] | |||||||||
В молекуле C60F18 симметрии C3v [129] все атомы
фтора присоединены к одной половине фуллеренового остова вокруг шестичленного
ароматического цикла, изолированного таким образом от π-системы остальной
части молекулы (Рис. 17а). При этом sp3-атомы C пирамидализованы, а
соседние с ними уплощены по сравнению с немодифицированным C60, вследствие
чего вся молекула принимает форму «панциря черепахи» (Рис. 18а).
Для описания возникающих в углеродном каркасе искажений применяется
сферический эксцесс — дополнение суммы углов C-C-C при данном атоме
углерода до 360o. В случае, когда вершина телесного угла при данном
атоме направлена внутрь молекулы, эксцесс считается отрицательным.
В деформированном углеродном каркасе можно выделить четыре области:
(а) плоский (сферический эксцесс φi=0.1o) ароматический шестичленный цикл с выровненными длинами связей C-C(1.372 Å), приближенный к центру молекулы;
(б) пояс из 18 фторированных атомов C(sp3), пирамидализованных (26.4o ≤ φi ≤ 29.9o) и удаленных от центра,
с одинарными связями C(sp3)-C(sp3) 1.54–1.67 Å;
(в) область из 12 атомов C(sp2) с уплощенным (φi = 3–6o) окружением, непосредственно примыкающих к фторированному поясу;
(г) «тыльная» часть молекулы, близкая по геометрии к неискаженному каркасу C60.
Три атома фтора, наиболее далеко отстоящие от изолированного 6-членного цикла, могут замещаться на фенильные группы по Фриделю-Крафтсу с образованием C60F15Ph3 [136], а также подвергаться нуклеофильному замещению [137]. Три симметрически эквивалентные одинарные связи C(sp3)-C(sp3) типа 5/6 удлинены до 1.67 Å. Присоединение атома кислорода по одной из таких связей с образованием C60F18O сопровождается её разрывом [130]. В структуре C60F17CF3 [131] трифторметильная группа занимает место одного из периферийных атомов фтора; в кристалле присутствует смесь двух изомеров замещения в разных ориентациях.
Строение фторида C60F20, не исследованного РСА, предположительно установлено методом ЯМР. По данным Болталиной и соавт. [138], в C60F20 все атомы фтора расположены по экватору молекулы, что показывает возможность их миграции по поверхности C60 в условиях синтеза.
Фторид C60F36 образует ряд изомеров. Наиболее распространённый изомер уникально редкой симметрии T был выделен и структурно исследован в виде сольвата с толуолом. Его молекула содержит четыре изолированных ароматических кольца с выровненными длинами связей, аналогичных ароматическому циклу в молекуле C60F18. Все остальные атомы углерода sp3-гибридизованы и связаны с атомами фтора. Сильно искаженный углеродный каркас приобретает форму, близкую к тетраэдру с закругленными ребрами и вершинами (Рис. 18б). В статически разупорядоченном кристалле содержится рацемическая смесь энантиомеров [132]. Второй по распространенности изомер, охарактеризованный ЯМР, имеет симметрию C3. Выделен и исследован методом РСА третий изомер, имеющий симметрию C1 [133].
Высший фторид фуллерена C60F48 исследован РСА в виде сольвата с мезитиленом [134,135]. Молекула расположена в частной позиции симметрии 3 псевдоцентрированной кубической ячейки (пр. гр. Pa3) и ротационно разупорядочена. В работе [134] структура C60F48 интерпретирована наложением смеси D3d- и S6-изомеров в общем соотношении 0.61:0.39. В [135] ячейка ошибочно проинтерпретирована как объёмноцентрированная (пр. гр. Ia3), а молекула C60F48 описана как изомер симметрии S6.
Длины связей C(sp3)-C(sp3) в C60F48 лежат в интервале 1.54–1.61 Å [134]. Шесть двойных связей С-С (1.29–1.30 Å), расположенных по вершинам октаэдра, в отличие от исходного фуллерена, относятся к типу 5/6 (Рис. 17в). Они существенно вдавлены внутрь молекулы (сферический эксцесс от -2 до -9o), что согласуется с невозможностью дальнейшего фторирования без разрушения углеродного каркаса [139].
Благодаря сильному электростатическому диполь-дипольному взаимодействию (дипольный момент 12–15 D в зависимости от использованного базиса по данным расчётов ab initio), в кристалле сольвата C60F18·C7H8 обе компоненты упорядочены и k=0.74, тогда как высокосимметричные C60F36 и C60F48, не имеющие дипольного момента, образуют разупорядоченные и более рыхлые упаковки (k=0.70–0.71, см. Табл. 4).
Хлорирование фуллерена приводит к смеси продуктов C60Cln, n ≤ 24, охарактеризованных методами ИК и масс-спектроскопии [140]. Применение мягкого хлорирующего агента (ICl) позволяет селективно получить C60Cl6. Его структура по данным ЯМР и ИК-спектроскопии аналогична структуре гексабромида (см. Рис. 19а) [141].
В продукте реакции C60Cl6 с метиллитием — гексаметилфуллерене C60Me6, исследованном методом РСА, экзополиэдрические фрагменты расположены аналогично гексахлориду [142]. Частичное замещение хлора метильными группами (до C60Me5Cl) с последующим нуклеофильным замещением Cl на OH и эпоксидированием двух связей C-C в обособленном пятичленном цикле даёт продукт состава C60Me4(OH)O2, также охарактеризованный РСА [143]. В его упорядоченной молекуле длины связей C(sp3)-C(sp3) 1.52–1.57 Å, в эпоксидных циклах C-C 1.48 Å, C-O 1.44–1.46 Å. Пять атомов хлора вокруг 5-членного цикла в C60Cl6 могут быть также замещены на фенильные группы по реакции Фриделя-Крафтса (в качестве побочного продукта образуется C60Ph4 [144]).
Проведено рентгеноструктурное исследование трёх бромидов фуллерена: C60Br6, C60Br8 и C60Br24 (шлегелевские проекции приведены на Рис. 19), закристаллизованных в виде сольватов с молекулярным бромом. В двух последних производных ближайшие атомы брома находятся в 1,3-положениях друг к другу, что, вероятно, объясняется стерическими причинами. В молекуле C60Br24 присутствуют изолированные двойные связи как типа 5/6, так и типа 6/6. Их длины сокращены до 1.33–1.34 Å, а связи с участием sp3-атомов C удлинены до 1.46–1.51 Å. Упаковка молекул C60Br24 в кристалле близка к ГЦК.
За исключением π-комплекса монооксида C70O (см. § 2.8), бинарные производные C70 и продукты их химической модификации к настоящему моменту структурно не исследованы. Основные продукты гидрирования имеют состав C70H36–C70H44 [119]. Предельным продуктом фторирования является, по-видимому, C70F56 [145], тогда как хлорирование останавливается на стадии C70Cl10 [146].
Функционализация молекулы фуллерена обычно включает в качестве первой стадии присоединение к кратной связи C-C типа 6/6. При этом экзо-координированные атомы углерода приобретают sp3-характер и выступают над поверхностью остова C60, что сопровождается удлинением соединяющей их связи C-C и возрастанием их сферических эксцессов φi до 16–32o (для ненапряженного тетраэдрического sp3-атома C φ = 31.7o). Основные типы продуктов σ-присоединения к молекуле C60 показаны на Рис. 20. Продукты многократного σ-присоединения к C60 одноэлектронных фрагментов были рассмотрены в предыдущем разделе.
Присоединение карбена к двойной связи С-С молекулы фуллерена даёт трёхчленный цикл (Рис. 20а). Удлинение ключевой связи C(sp3)-C(sp3) в среднем до 1.59 Å (Рис. 21), что больше типичной длины одинарной связи C-C, указывает на значительные стерические напряжения вокруг sp3-атомов в фуллереновом каркасе. Четырёхчленные циклы найдены только в производных димерной молекулы (C60)2. Многочисленные производные с пяти- и шестичленными циклами (Рис. 20б-г) образуются в реакциях [2+3] и [2+4] циклоприсоединения. Средняя длина связи C-C, по которой происходит присоединение, при этом возрастает еще больше: до 1.60 и 1.61 Å, соответственно (см. Рис. 21). Изменения длин связей в координированном каркасе C60 показаны на Рис. 22.
Более редки гомофуллерены (продукты присоединения по связи 5/6). Данная связь является формально одинарной, и присоединение по ней приводит к её разрыву и отдалению атомов C на расстояние порядка 2.1 Å [130,147].
Функционализация двойной связи активирует для присоединения пять других связей 6/6, расположенных вместе с ней по вершинам октаэдра в остове C60 (Рис. 20д). Дальнейшее присоединение, как правило, происходит по этим связям, давая в пределе гексааддукт с Th-симметрией углеродного каркаса (Рис. 20е). Структурно исследован, в частности, один из таких аддуктов, содержащий шесть малонатных групп: C60(C(COOEt)2)6 [148].
Фуллерен C70 содержит восемь неэквивалентных связей C-C, обладающих различной стерической доступностью. В большинстве исследованных продуктов его химического модифицирования присоединение происходит по двойной связи типа b (см. Рис. 2), которая из всех связей 6/6 имеет наибольшую сумму эксцессов образующих её атомов. Исключениями являются: один продукт [2+4] присоединения диена C10H12O2 по связи типа d [149] и гомофуллерен, образовавшийся в результате присоединения CCl2-карбена по одинарной связи типа f с её разрывом [147]. Структурно исследованные σ-производные C70 малочисленны, и среди них не имеется примеров многократного присоединения с изолированным расположением остовов фуллерена.
Оксид осмия OsO4, применяемый в органической химии как окислитель алкенов до диолов, вступает в аналогичную реакцию с бакминстерфуллереном, давая осматный эфир 1,2-фуллеренола. Его комплекс состава C60O2OsO2(p-BuPy)2 — первое из структурно исследованных производных фуллерена [150]. Известны также другие комплексы, в которых атомы металла связаны с экзополиэдрическими фрагментами — например, сольват C60S2Fe2(CO)6, в котором атомы серы, координирующие биядерный фрагмент Fe2(CO)6, ковалентно присоединены к фуллерену в 1,2-положениях [151].
Кроме уже упоминавшегося димера фуллерена (см. § 2.4), существуют и другие молекулы, содержащие два связанных фуллереновых фрагмента. Оксибифуллерен C120O структурно исследован в виде молекулярного комплекса с октаэтилпорфирином. Атом кислорода разупорядочен, однако установлено, что молекула представляет собой димер C60, в котором одна из межфуллереновых связей C-C заменена мостиком C-O-C [91]. В молекуле (C60C(–CC–SiPri3))2CC–CC (Рис. 23а) два 1,2-замещенных фуллереновых остова соединены 4-атомным карбиновым мостиком [152]. Исследовано производное димера C60, в котором каждый фуллереновый остов дополнительно функционализирован по пяти связям, расположенным так же, как в гексааддуктах C60 (Рис. 23б) [153]. Получен и исследован РСА металлокомплекс, включающий два фуллереновых фрагмента, каждый из которых модифицирован в гексааддукт, являющийся бидентатным σ-лигандом. Два фрагмента соединены двумя мостиковыми атомами Pt (Рис. 23в) [154]. Первый фуллеренсодержащий криптанд, тетракис(N,N'-диметилпропандиамин-N,N')-бис(эпоксифуллерен) (C60O)2(N(CH3)(CH2)3N(CH3))4 — производное гексахлорида фуллерена, в котором два атома хлора замещены на эпоксидный атом кислорода, а остальные четыре — на мостиковые пропандиаминовые группы, соединяющие два фрагмента C60O (Рис. 23г) [155].
Кристаллические упаковки в химически модифицированных производных фуллерена подчиняются тем же закономерностям, что и в молекулярных комплексах. При наличии внешнего фрагмента малого размера (атом O) образуется упаковка, аналогичная структуре чистого C60 (см. разд. 2.6). Ковалентно связанный экзополиэдрический фрагмент с размерами, меньшими ван-дер-ваальсова диаметра фуллереновой сферы, играет роль «разбавляющей» компоненты в обычных структурных мотивах из фрагментов C60 (см. Табл. 3). Так, например, в кристалле карбенового моноаддукта C60C(COOEt)2·CHCl3 [156] (ρ = 0.81) присутствует упаковка типа трёхмерного каркаса с МКЧ=8 (где МКЧ понимается применительно к фуллереновой субъединице, а не ко всей молекуле). 3-бензилоксикарбонил-(60)фуллерено(1,2-d)изоксазол, в котором к фуллерену присоединен 5-членный изоксазольный цикл, содержит гексагональные слои сфер C60 [157]. Экзополиэдрические фрагменты большего размера вместе с сольватными молекулами приводят к образованию более разреженных упаковок вплоть до изолированного расположения фуллереновых остовов, как, например, в гексааддукте C60(C(COOEt)2)6 [148]. Наличие фрагментов, присоединенных к фуллереновому каркасу, препятствует ротационной разупорядоченности, увеличивая точность определения структуры.
Химия фуллерена как π-лиганда позволяет отнести его скорее к полиалкенам, чем к ароматическим углеводородам. Химически не модифицированный бакминстерфуллерен служит исключительно лигандом η2-типа, способным координировать несколько атомов металла. Как и в случае σ-связывания, присоединение металла к одной связи 6/6 в бакминстерфуллерене активирует пять таких же связей, расположенных по вершинам октаэдра в фуллереновом каркасе (Th-симметрия, см. Рис. 20е). Удлинение ключевой связи 6/6 при π-присоединении в среднем несколько меньше, чем при σ-координации (см. Рис. 21). Близкое расположение связей 6/6 позволяет фуллерену быть также полидентатным η2:η2- и η2:η2:η2- лигандом в комплексах с кластерами металлов платиновой группы (Рис. 24). Структурно исследована серия комплексов Os и Ru, в которых три атома металла, образующие кластер, координированы тремя двойными связями, находящимися в одном шестичленном цикле. Получены также комплексы, в которых бакминстерфуллерен служит как монодентатным [158], так и тридентатным лигандом [159] при трёхъядерном карбонильном кластере осмия. В КБСД имется 29 структур, в которых фуллерен координирован с одним атомом металла, 10 комплексов с двумя атомами металла, 10 — с тремя, 2 — с четырьмя, 8 с пятью и 4 комплекса с шестью атомами металла. Известны примеры π-комплексов, содержащих два фуллереновых лиганда при одной кластерной группировке Rh6 [160], и даже при одном атоме металла (Рис. 24д) [161]. Для π-комплекса [(η2-C60)Ir(o-HCB10H9CCH2PPh2)(ButNC)2], содержащего в одной молекуле фрагменты карборана и фуллерена, методом РСА зафиксировано внедрение молекулы O2 по одной из связей металл-углерод. В образующемся 5-членном пероксидном металлоцикле присутствует σ-связь Ir-C длиной 2.24 Å [162].
При образовании π-комплекса длина координирующей связи 6/6 возрастает в среднем до 1.48 Å. Соседние с ней связи типа 5/6 удлиняются до 1.49 Å. Наблюдается также некоторое перераспределение длин соседних связей (см. Рис. 22). Как и в случае σ-производных, влияние η2-координации на соседние связи быстро затухает с удалением от координированной связи и практически не затрагивает «тыльной» половины фуллеренового остова.
В ряде молекулярных комплексов фуллеренов с металлопорфиринами и родственными им соединениями атомы металла участвуют во «вторичных» взаимодействиях с углеродным каркасом LM···Cn (где L — макроциклический лиганд). Расстояния M···C при таких взаимодействиях лежат в интервале между обычной π-координацией (≈ 2.0–2.3 Å) и ван-дер-ваальсовым контактом ( ≥ 3.0 Å). Пример таких взаимодействий представляет комплекс C60·C44H28N4Fe+·(C6F5)4B-·2.5(o-C6H4Cl2) (расстояния Fe···C 2.70 Å) [163]. Во многих случаях вторичные взаимодействия металл-фуллерен стабилизируют определённую ориентацию фуллеренового каркаса, препятствуя разупорядоченности. Однако в некоторых соединениях этого типа, например в комплексе фуллерена с тетракис(3,5-ди-трет-бутил-фенил)порфиринатом кобальта, наряду с короткими контактами Co···C (2.59 Å), наблюдается разупорядочение фуллеренового остова [164].
Известна серия однотипных комплексов фуллеренов с иридием (фуллерен)·[Ir(CO)(Cl)(PPh3)2]n, n=1, 2 (где фуллерен = C60, C60O, C70, C70O и C84). Геометрические параметры этих комплексов приведены в Табл. 5. Координация атома иридия во всех них близка к симметричной тригонально-бипирамидальной. Фуллереновый лиганд занимает в координационной сфере Ir несколько больше пространства, чем трифенилфосфин (валентный угол P-Ir-P < 120o).
| Таблица 5. Геометрические параметры координационного окружения атома Ir в π-комплексах (η2-фуллерен)Ir(CO)Cl(PPh3)2 |
|||||||
|---|---|---|---|---|---|---|---|
| C60 | C60/2 | C60O | C70 | C70/2 | C70O | C84 | |
| Ir-C, Å | 2.190 | 2.171 | 2.172 | 2.182 | 2.176 | 2.234 | 2.197 |
| Ir-CO, Å | 1.923 | 1.852 | 1.840 | 1.834 | 1.838 | 1.845 | 1.824 |
| Ir-Cl, Å | 2.401 | 2.410 | 2.396 | 2.362 | 2.366 | 2.355 | 2.418 |
| Ir-P, Å | 2.384 | 2.330 | 2.386 | 2.384 | 2.356 | 2.364 | 2.376 |
| P-Ir-P, o | 113.4 | 109.8 | 113.5 | 114.9 | 104.2 | 114.5 | 114.7 |
| Cl-Ir-CO, o | 179.7 | 175.8 | 179.0 | 178.8 | 176.1 | 178.7 | 178.4 |
| ссылка | [165] | [166] | [116] | [167] | [168] | [118] | [23] |
Пентакоординированный фуллереновый фрагмент C60R5, получаемый на основе гексахлорида C60, является аналогом пентазамещенного циклопентадиена и проявляет способность к η5-координации. Структурно исследована таллиевая соль C60Ph5 [169], родственная моноциклопентадиенильным комплексам p-элементов с преимущественно ионным связыванием металл-лиганд η5-типа (Tl-C = 2.83–2.89 Å). Атом таллия дополнительно координирован атомом кислорода сольватной молекулы ТГФ на расстоянии 3.16 Å. Описан также комплекс родия C60Me5Rh(CO)2, в котором фуллереновый остов C60Me5 выполняет роль настоящего η5-лиганда при атоме металла [170] с расстояниями Rh–C 2.12–2.27 Å.
Фуллерен C70, как и в случае σ-присоединения, в большинстве π-комплексов присоединяет внешние атомы металла по связи типа b, а в комплексах с кластерами или несколькими отдельными атомами металла — по связям b и d. Известно одно производное состава C70(C6H4CF3)3Tl·C6H4Cl2, в котором C70 выступает в качестве аниона, подобного циклопентадиенильному [171]. Структуры η5-координированных C60 и C70 схематически представлены на Рис. 25.
Как со структурной, так и с химической точек зрения чрезвычайно интересны металлокомплексы фуллеренов, в которых атомы металла связаны с сильно модифицированным «вскрытым» углеродным каркасом с участием присоединенных функциональных групп. Так, в соединении C60C4H4CoCp·C7H8 атом кобальта координирован бис-гомофуллереновым лигандом по (η2,σ,σ)-типу (Рис. 24е) [172]. В данном соединении углеродный каркас вскрыт с образованием 11-членного цикла.
Кристаллические упаковки в π-комплексах фуллеренов, как и упаковки прочих фуллереновых производных, могут быть описаны в терминах мотивов из фуллереновых сфер. Особенностью данного класса является то, что в π-комплексах нефуллереновая часть, как правило, относительно велика, что часто приводит к образованию ажурных или изолированных мотивов. Исключением являются комплексы с Pd и Pt состава C60Mn, отнесённые в этом обзоре к фуллеридам (см. § 2.3).
Крупные и стерически нежёсткие молекулы π-комплексов часто допускают образование нескольких сольватов разного состава с одним и тем же растворителем, как, например, в случае комплекса C60[Ir(CO)Cl(PPhMe2)2]2 и бензола (Рис. 26) [166]. В одном из сольватов состава C60(Ir(CO)Cl(PPhMe2)2·C6H6 (ρ = 2.21) фуллереновые остовы изолированы друг от друга, а во втором сольвате состава C60(Ir(CO)Cl(PPhMe2)2·2C6H6 (ρ = 2.45) они образуют разделённые зигзагообразные цепочки.
Особое место среди фуллереновых производных занимают эндоэдральные фуллерены, внутри углеродного каркаса которых присутствуют «гости»: атомы металлов или неметаллов (в том числе инертных газов), либо малые кластеры. Закономерности образования таких соединений рассмотрены в обзоре [173]. Эндоэдральные металлофуллерены (ЭМФ) были впервые зафиксированы методом масс-спектрометрии в 1985 г. одновременно с « полыми» фуллеренами [174] и выделены в микрограммовых количествах в 1991 г. [175]. Однако их структурные исследования затруднены высокой реакционной способностью и наличием изомеров (см. ниже).
Нагревание фуллеренов Cn в атмосфере инертного газа A под давлением позволяет получить примесные количества эндоэдральных производных A@Cn [176]. Соединения C60 с 3He [177] и 129Xe [178] охарактеризованы спектрами ЯМР. Для C70 этим методом были также получены соединения A2@C70 (A = He [179] и Ne [180]) с двумя атомами инертных газов в полости фуллеренового каркаса. Соотношение продуктов A@C70 и A2@C70 указывает на «классический» механизм реакции синтеза, включающий разрыв связи С-С с последующим замыканием углеродной клетки. РСА твёрдого раствора Kr@C60 в кристаллическом C60·Ni(OEP)·2C6H6 выявил атом Kr в центре фуллеренового каркаса на расстоянии 3.54 Å от атомов С (на 0.2 Å меньшим суммы их вандерваальсовых радиусов). По результатам уточнения заселённости позиции Kr, содержание Kr@C60 в монокристалле составило 9% [181]. Соединения X@C60 (где X = Li [182], N [183] и P [184]) получены ионной бомбардировкой пленки C60 в вакууме и охарактеризованы ЭПР-спектрами.
Обычным методом синтеза эндоэдральных металлофуллеренов является плазменная перегонка графита с примесью оксида соответствующего металла (1–2 ат. %) в атмосфере Не (10–100 торр). В масс-спектрах продуктов перегонки, наряду с C60+ и C70+, присутствуют ионы MCn+ (где n = 60–100) с преобладанием MC60+ и MC82+ [173]. Экстракция полярными органическими растворителями либо CS2 с последующим хроматографическим разделением позволяет получить преимущественно M@C82, M@C84 и M2@C80, умеренно устойчивые на воздухе, тогда как индивидуальные M@C60 труднее выделить ввиду их высокой реакционной способности. В настоящее время получены ЭМФ свыше 20 металлов, преимущественно лантаноидов (Ln), в количествах до нескольких миллиграммов [185–188].
Структурные исследования ЭМФ (как и «полых» высших фуллеренов) осложняются изомерией их углеродного каркаса [185]. Квантовохимические расчёты ЭМФ выявили существенный перенос заряда с атома металла на углеродный остов, стабилизирующий более симметричные изомеры вплоть до нарушения правила изолированных пятиугольников [189]. Расчёты с оптимизацией геометрии моноядерных металлофуллеренов M@Cn предсказывают сдвиг атома металла из центра полости с появлением внутриполиэдрических связывающих контактов М–C ≈ 2.5 Å и значительный дипольный момент молекулы (4–5 D). Из квантовохимических и спектроскопических данных также следует легкость миграции атомов металла внутри углеродного каркаса, что может дополнительно осложнять структурные исследования [11,185,189,190].
Наиболее изученные моноядерные производные Ln@C82 [186], по спектроскопическим данным, получены в виде смеси изомеров симметрии C2v, (изомер I, содержание 70–80%) и C3v, (II, 20–30%) (Рис. 27). В производных некоторых металлов зафиксированы также изомеры III (Er, Dy, Tm, Ca) и IV (Ca) [188,191]. Поэтому получение чистых металлофуллеренов для структурного исследования, во избежание статической разупорядоченности, включает трудоемкое хроматографическое разделение изомеров.
Экспериментальные структурные данные для большинства эндоэдральных фуллеренов получены методами XAFS-спектроскопии [192–196] и порошковой рентгеновской дифракции на синхротронном излучении. Положение и форма края полосы поглощения в рентгеновских спектрах (XANES) подтверждают внутримолекулярный перенос электрона с «гостевого» атома металла на углеродную оболочку кластера. В EXAFS-исследованиях Y@C82 [193] и La@C82 [194] был впервые установлен сдвиг атома металла из центра фуллереновой полости и его координация с атомами «стенок».
Систематические дифракционные исследования, проведенные в 1995–2001 г.г. японскими авторами, позволили определить методом максимальной энтропии (MEM) основные черты кристаллической и молекулярной структуры в серии поликристаллических ЭМФ [87, 197–201]. Во всех случаях было объективно выявлено вхождение атомов металла в полость углеродного каркаса. Сообщалось также, что в биядерном Sc2@C66 геометрия углеродной оболочки, в согласии с квантовохимическими расчётами, не удовлетворяет правилу изолированных пятиугольников [9]. В сильно разупорядоченной кристаллической структуре Sc2C2@C84 [202] внутри углеродной оболочки обнаружен карбидный кластер с атомами С на расстоянии 1.42(6) Å друг от друга. Расстояния металл-металл в биядерных La2@C80 (3.90–3.94 Å) [200] и Sc2@C84 (3.91 Å) [199] показывают отсутствие связи металл-металл, тогда как в Sc2@C66 внутри полости меньшего размера обнаружена связь Sc-Sc 2.89 Å [9]. В то же время в сольвате трёхъядерного Sc3@C82 с толуолом (1:1) из-за вероятной ротационной разупорядоченности молекул ЭМФ найдены аномально короткие расстояния Sc-Sc 2.3(3) Å [201] (против 3.20–3.30 Å в металлическом скандии [203]), не согласующиеся с результатами квантовохимического расчёта [189]. Представленные в [9,87,197,199,201] оценки заряда эндоэдральных фрагментов интегрированием электронной плотности, полученной в МЕМ, также вызывают возражения как выходящие за пределы точности метода порошковой рентгенографии. Однако в целом XRD-исследования ЭМФ представили важную структурную информацию на полуколичественном уровне.
В последние годы Балчем, Олмстед и соавт. опубликованы результаты монокристального РСА серии эндоэдральных фуллеренов M3N@Cn (где M = Sc, Er; n = 78, 80) с плоскими треугольными металл-нитридными кластерами внутри высокосимметричной углеродной оболочки [204–206]. Эти соединения были синтезированы плазменным методом в динамической атмосфере, содержащей N2, и кристаллизованы в виде молекулярных комплексов (1:1) с октаэтилпорфиринатом кобальта CoOEP и сольватными молекулами растворителя. Короткие межмолекулярные контакты Co···C(фуллерен) 2.71–2.78 Å в этих структурах сосуществуют с сильной ротационной разупорядоченностью как углеродных каркасов, так и внутренних плоско-тригональных фрагментов-«гостей» M3N. В [204–206] объективно установлены строение высокосимметричных углеродных оболочек C78 (D3h) и C80 (Ih), стабилизированных переносом заряда от атомов металла, и геометрия фрагмента M3N (Рис. 28), а также отмечена лабильность связывания M···C с углеродным каркасом.
Несольватированные ЭМФ при комнатной температуре имеют разупорядоченную ГЦК-решётку [207], изоморфную высокотемпературным модификациям C60 и C70. Медленное охлаждение монокристалла La@C82 приводит к ориентационному упорядочению эллипсоидальных молекул ЭМФ с переходами в ромбоэдрическую (180–150 К) и метастабильную триклинную модификации (150–20 К). При быстром охлаждении ромбоэдрического полиморфа образуется разупорядоченная простая кубическая фаза, стабильная ниже 132 К [207]. В сильно разупорядоченных сольватах M@C82·1.5CS2 молекулы сероуглерода занимают пустоты ОЦК-решётки; при 150 К зафиксирован магнитный фазовый переход, объясняемый ориентационным упорядочением фуллереновых остовов [208]. Как и чистые фуллерены, их эндоэдральные производные могут полимеризоваться под давлением [209].
По кристаллографическим данным моноклинные толуольные сольваты M@C82·C6H5CH3 изоморфны аналогичным сольватам «пустых» высших фуллеренов C82·C6H5CH3 и C76·xC6H5CH3 [21]. Мотив расположения фуллереновых остовов в них совпадает с найденным ранее для сольватов (1:1) бакминстерфуллерена C60 с н-пентаном, дихлорэтаном и другими растворителями [86] (см. Рис. 10), а межмолекулярные электростатические взаимодействия стабилизируют упаковку молекул «голова к хвосту» [198]. В кристаллах M3N@C80·CoOEP·solv обнаружены зигзагообразные цепочки, подобные существующим в молекулярных комплексах C60 и C70 с металлопорфиринами (см. Рис. 12). Ближайшие расстояния между центрами фуллереновых остовов в исследованных ЭМФ лежат в интервале 11.00–11.22 Å.
Некоторые корреляции «структура-свойство»
Характерные черты кристаллохимии фуллеренов определяются присутствием в них крупных кластеров углерода, близких к сферической форме, и преобладанием невалентных межмолекулярных взаимодействий. Данные структурных исследований различных фуллереновых производных, включая химически модифицированные и эндоэдральные фуллерены, показывают характерную разупорядоченность углеродного полиэдра (уменьшающуюся с понижением температуры), склонность к образованию молекулярных кристаллов и разнообразие кристаллических фаз. Во всех рассмотренных классах соединений наблюдаются сходные мотивы расположения фуллереновых остовов, определяемые в первую очередь долей занимаемого ими объёма в общем объёме кристалла. Нефуллереновые молекулы и экзополиэдрические фрагменты заполняют пустоты в таких мотивах, выступающих в роли лабильной ван-дер-ваальсовой матрицы.
Кулоновское притяжение (в ионных фуллеридах) и специфическое межмолекулярное связывание стабилизируют кристаллическую упаковку производных фуллеренов, повышая степень её упорядоченности и точность дифракционного иследования соответствующих кристаллических структур. В ряде работ отмечены слабые ян-теллеровские искажения моно- и дианионов бакминстерфуллерена C60, а также повышенная склонность анионных фуллереновых каркасов к полимеризации.
В эндоэдральных фуллеренах наличие атомов-«гостей» внутри фуллеренового остова способно как стабилизировать кристаллическую упаковку ввиду поляризации угледродных кластеров, так и усиливать их разупорядочение за счёт различных положений атомов или (и) их динамических переходов внутри каркаса. В эндоэдральных металлофуллеренах, по квантовохимическим и спектроскопическим данным, наблюдается внутримолекулярный перенос электронов металл→каркас, стабилизирующий более симметричные изомеры углеродной оболочки. Появление таких новых степений свободы, как дипольный момент молекулы и магнитные моменты атомов-«гостей», увеличивает число возможных типов упорядочения и соответствующих им фазовых переходов.
Для химически модифицированных фуллеренов (как в σ-, так и в π-производных) типично присоединение к связи 6/6, сопровождаемое её удлинением и однотипными искажениями углеродного остова, локализованными в ближайшем окружении экзополиэдрически координированных атомов. Для молекул C70 предпочтительна координация по стереохимически напряженной связи 6/6 (тип b), атомы С при которой наиболее пирамидализованы. Для наиболее изученных производных C60 и C70 также установлено присоединение по связям 5/6 с разрывом этих связей и образованием «приоткрытых» гомофуллереновых каркасов. По сравнению с кристаллами немодифицированных фуллеренов, их функционализированные производные обычно лучше упорядочены ввиду несферической формы их молекул.
Многократное присоединение (как по σ,σ-, так и по η2-типу) экзополиэдрических фрагментов, не взаимодействующих друг с другом, протекает по наиболее удаленным связям 6/6 вплоть до образования, в случае C60, гексааддуктов с октаэдрическим окружением фуллеренового остова. Для экзополиэдрических кластеров характерна многоцентровая координация атомов переходного металла, соединенных связями М-М, по 6-атомной грани углеродного полиэдра, тогда как π-координация σ-модифицированного фуллерена одиночным атомом металла может проходить по типам η5- и, возможно, η6-связывания. Глубокая химическая модификация фуллеренов приводит к сильным искажениям их полиэдрических каркасов и может сопровождаться раскрыванием углеродной клетки.
Характеристика объектов исследования
Исследованные нами соединения принадлежат к классу молекулярных комплексов. Два из них (XIII и XV) являются молекулярными комплексами C70, а в двух комплексах C60 (VII и XVI) молекула бакминстерфуллерена несёт отрицательный заряд, являясь таким образом анион-радикалом.
Среди исследованных производных фуллеренов можно выделить четыре группы: (а) сольваты с ароматическими растворителями I–IV, а также молекулярные комплексы (б) с полиаренами V–VII, (в) с производными тетратиафульвалена VIII и IX и (г) с тетрафенилпорфирином и тетрафенилпорфиринатами металлов X–XVI. Большинство из соединений, использованных в качестве нефуллереновых компонент, имеют сравнительно низкие потенциалы ионизации, т.е. являются потенциальными донорами электронов. Помимо полного переноса заряда к фуллерену в VII и XVI, приводящего к возникновению электростатических взаимодействий, в комплексах с металлопорфиринами могут существовать слабые («вторичные») связывающие взаимодействия M···C(C60) (где M — металл в составе координационного соединения с порфирином). В то же время большинство межмолекулярных взаимодействий в I-XVI относится к типу ван-дер-ваальсовых, сопровождаясь обычными невалентными контактами на расстояниях порядка сумм их ван-дер-ваальсовых радиусов.
В Табл. 6 приведены основные кристаллохимические параметры исследованных соединений. Кратко охарактеризован мотив упаковки фуллереновых молекул. Термин «колоночный» применяется для описания мотива, в котором каждая молекула фуллерена имеет двух соседей, расположенных строго с противоположных сторон; зигзагообразный одномерный мотив обозначается как «цепочечный». Под островным мотивом понимается такое расположение молекул фуллерена, при котором контакты не объединяют их в бесконечные агрегаты; частный случай, когда молекулы фуллерена вовсе не контактируют между собой, называется изолированным мотивом. Коэффициент упаковки по Китайгородскому k, определяемый как отношение суммарного ван-дер-ваальсова объёма молекул к объёму элементарной ячейки [76], является характеристикой плотности упаковки молекул, и для большинства молекулярных кристаллов лежит в интервале 0.68–0.82. Значения k, лежащие вне этого интервала, как правило, свидетельствуют об ошибке в структурном иследовании. Параметр разбавления ρ, впервые введенный в [79] и определяемый как отношение объёма части ячейки, не занятой фуллереном, к объёму фуллерена, характеризует разреженность мотива из фуллереновых сфер. По его значению можно сделать предварительный вывод о том, к какому типу (плотный каркасный, плотный слоистый, разреженный каркасный, разреженный слоистый, колоночный, островной и др.) относится данный мотив.
В согласии с литературными данными, немодифицированные молекул фуллерена и анионы C60- в ряде исследованных кристаллов подвержены ротационной разупорядоченности. Среди молекулярных комплексов I-XVI наблюдается широкий спектр степени упорядочения кристалла от полностью упорядоченных (II, III) до сильно разупорядоченных (XVI) структур. В Табл. 6 приведены данные об упорядоченности фуллерена (а), органического донора (б) и растворителя (в).
Использованные сокращения:
| TPB | — 1,3,5-трифенилбензол C6H3Ph3 |
| H2TPP | — тетрафенилпорфирин |
| CuTPP | — тетрафенилпорфиринат меди |
| CoTPP | — тетрафенилпорфиринат кобальта |
| PyZnTPP | — пиридин-тетрафенилпорфиринат цинка |
| BNTTF | — бис(4,5-дигидронафто[1,2-d])тетратиафульвален |
| EDT(DET)TTF | — ди(этилтио)этилендитиотетратиафульвален |
| TBPD | — N, N, N', N'-тетрабензилпарафенилендиамин |
| TDAE | — тетракис(диметиламино)этилен |
| TMTSeF | — тетраметилтетраселенафульвален |
| TMDTDM-TTF | — тетраметилендитиодиметилтетратиафульвален |
| BET-TTF | — бис(этилентио)тетратиафульвален |
| TTC1-TTF | — бис(метилтио)этилендитиотетратиафульвален |
| DBTTF | — дибензотетратиафульвален |
| BDMT-TTeF | — бис(диметилтиено)тетрателлурафульвален |
| TTM-TTF | — тетракис(метилтио)тетратиафульвален |
| Таблица 6. Кристаллохимические параметры исследованных структур |
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Формула | Пр.гр. | Мотив (C60)n | k* | ρ* | Набл. отражений/ параметров | R-фактор (F > 4σ) | Упорядочение** | |||
| а | б | в | ||||||||
| I | C60·2(C6H5Br) | C2/m | Слоистая | 0.78 | 0.80 | 1776/205 | 0.061 | – | + | |
| II | C60·2(C6H5I) | C2/c | Слоистая | 0.81 | 0.82 | 4467/334 | 0.030 | + | + | |
| III | C60·2(m-C6H4Br2) | C2/m | Искаж. ПК | 0.80 | 0.90 | 2553/188 | 0.029 | + | + | |
| IV | C60·3(o-C6H4Br2) | P21/c | Алмазоподобн. | 0.80 | 1.22 | 4751/698 | 0.144 | + | – | |
| V | C60·C6H3Ph3 | P21/c | Графит. слои | 0.77 | 1.07 | 4882/902 | 0.078 | – | + | |
| VI | C60·2C6H3Ph3·PhCl | P1 | Колонки | 0.77 | 2.11 | 6297/507 | 0.090 | + | + | – |
| VII | C60·2TBPD·TDAE | I4/m | Островной | 0.76 | 3.38 | 1150/213 | 0.100 | – | –*** | |
| VIII | 2C60·BNTTF·PhMe | P21/c | Плотный каркас | 0.78 | 0.85 | 8686/1378 | 0.099 | + | + | – |
| IX | 2C60·EDT(DET)TTF | P21/c | Плотный каркас | 0.80 | 0.77 | 7306/1202 | 0.136 | – | –**** | |
| X | 2C60·H2TPP·3C6H6 | R3 | Ажурный каркас | 0.74 | 1.43 | 6767/839 | 0.133 | – | + | – |
| XI | 2C60·H2TPP·4C6H6 | P21/c | Гофр. граф. слои | 0.74 | 1.54 | 10485/1192 | 0.061 | – | + | + |
| XII | C60·2CuTPP | C2/c | Колонки | 0.77 | 3.20 | 8739/706 | 0.058 | – | + | |
| XIII | C70·CuTPP·1.5C6H5Me·0.5C2HCl3 | P1 | Цепочки | 0.72 | 2.15 | 14019/1174 | 0.100 | + | – | – |
| XIV | C60·2PyZnTPP·C6H5Me·Cp2Fe | C2/c | Изолир. | 0.72 | 4.55 | 6851/802 | 0.099 | – | + | – |
| XV | C70·2PyZnTPP·C6H5Me·0.5C2HCl3 | C2/c | Изолир. | 0.70 | 3.86 | 5718/792 | 0.116 | – | + | – |
| XVI | C60Cs·CoTPP·1.7PhCN·0.3(o-C6H4Cl2)·CH3CN | P1 | Островной | 0.76 | 2.48 | 11922/845 | 0.120 | – | – | – |
| * k — коэффициент упаковки [76], ρ — параметр разбавления [79]; ** (а) — молекула фуллерена, (б) — молекула донора, (в) — молекула растворителя; *** TBPD упорядочен, TDAE разупорядочен; **** одна из двух независимых молекул C60 разупорядочена | ||||||||||
В Табл. 7 перечислены длины связей типа 5/6 и типа 6/6 в молекуле бакминстерфуллерена в исследованных соединениях. Поскольку реальная геометрия жёсткой молекулы C60 в них практически неизменна, эти величины могут служить косвенным показателем достоверности определения структуры, коррелирующим с отмеченной в Табл. 6 ротационной разупорядоченностью. Так, в упорядоченных структурах II и III, а также в структурах VI и VIII с упорядочеными молекулами фуллерена и донора указанные длины связей варьируют в узких интервалах, а их средние значения согласуются с результатами ГЭ [13]. В то же время разупорядочение молекул C60 сопровождается широкими интервалами длин связей 5/6 и 6/6, хотя средние длины этих связей по-прежнему согласуются с их стандартными значениями. Интересно отметить, что в IV с разупорядоченностью молекул растворителя, содержащих тяжёлые атомы Br, интервалы расстояния C-C в упорядоченных молекулах C60 заметно уширены. Цифрами 1 и 2 обозначены разные ориентации разупорядоченных молекул фуллерена; буквами A и B — разные симметрически независимые молекулы в случаях VIII и IX. Типы разупорядоченности в последней колонке указаны в соответствии с Рис. 15 из Литературного обзора. Для структур VII и XII приведены длины связей только одной ориентации разупорядоченной молекулы C60, т.к. вторая ориентация является симметрическим эквивалентом первой. В случаях V, IX и XVI геометрия молекулы фуллерена уточнялась с ограничениями (см. Экспер. часть).
| Таблица 7. Длины симметрически независимых связей C-C молекулы C60 в исследованных соединениях, Å |
|||||
|---|---|---|---|---|---|
| Соединение | 6/6 | 5/6 | Тип разупоряд.* | ||
| Интервал | Среднее | Интервал | Среднее | ||
| I(1) | 1.38–1.43 | 1.39 | 1.42–1.48 | 1.45 | а |
| I(2) | 1.21–1.45 | 1.40 | 1.38–1.59 | 1.47 | |
| II | 1.39–1.40 | 1.39 | 1.44–1.46 | 1.45 | Упоряд. |
| III | 1.38–1.39 | 1.39 | 1.44–1.46 | 1.45 | Упоряд. |
| IV | 1.23–1.48 | 1.36 | 1.38–1.58 | 1.46 | Упоряд. |
| V(1) | 0.89–1.59 | 1.33 | 1.27–1.92 | 1.48 | б |
| V(2) | 0.96–1.47 | 1.32 | 1.36–1.78 | 1.48 | |
| VI | 1.39 | 1.39 | 1.44–1.45 | 1.45 | Упоряд. |
| VII | 1.20–1.89 | 1.43 | 1.20–1.69 | 1.44 | а |
| VIII(A) | 1.32–1.41 | 1.36 | 1.42–1.50 | 1.46 | Упоряд. |
| VIII(B) | 1.32–1.41 | 1.36 | 1.40–1.53 | 1.45 | Упоряд. |
| IX(A) | 1.28–1.42 | 1.35 | 1.39–1.57 | 1.46 | Упоряд. |
| IX(B1) | 1.28–1.34 | 1.31 | 1.46–1.54 | 1.50 | Неопр. |
| IX(B2) | 1.34–1.47 | 1.36 | 1.44–1.58 | 1.48 | |
| X | 1.01–1.84 | 1.34 | 0.94–1.89 | 1.48 | Неопр.** |
| XI(1) | 1.21–1.42 | 1.36 | 1.36–1.64 | 1.47 | б |
| XI(2) | 0.95–1.54 | 1.32 | 1.37–1.93 | 1.50 | |
| XII | 1.35–1.43 | 1.40 | 1.36–1.62 | 1.45 | а |
| XIV(1) | 1.30–1.44 | 1.38 | 1.35–1.59 | 1.45 | а |
| XIV(2) | 1.36–1.50 | 1.41 | 1.37–1.71 | 1.46 | |
| XVI(1) | 1.07–1.73 | 1.36 | 1.03–1.79 | 1.47 | б |
| XVI(2) | 1.03–1.79 | 1.44 | 1.07–1.82 | 1.46 | |
| Литер. | 1.40 | 1.46 | [13] | ||
| * Тип разупорядоченности C60
дан в соответствии с Рис. 15 (см. Литературный обзор) ** Разупорядоченность C60 не удалось охарактеризовать | |||||
Длины симметрически независимых связей C-C молекулы C70 в XIII и XV в сравнении с литературными данными приведены в Табл. 8. Разупорядоченная молекула C70 в XV уточнялась с ограничением, наложенным на её геометрию: длины симметрически эквивалентных связей были выровнены. В структуре XIII длины связей в упорядоченной молекуле C70 хорошо согласуются с наиболее точными литературными данными для молекулярного комплекса C70·6S8 [16].
| Таблица 8. Длины связей C-C молекулы C70 в исследованных соединениях, Å |
|||||||||
|---|---|---|---|---|---|---|---|---|---|
| Соединение | a | b | c | d | e | f | g | h | Ссылка |
| C70·CuTPP·1.5C6H5Me·0.5C2HCl3 (XIII) | 1.45 | 1.36 | 1.46 | 1.36 | 1.45 | 1.44 | 1.41 | 1.49 | [210] |
| C70·2PyZnTPP·C6H5Me·0.5C2HCl3 (XV) | 1.55 | 1.27 | 1.56 | 1.23 | 1.45 | 1.41 | 1.41 | 1.53 | [210] |
| C70·6S8 | 1.45 | 1.38 | 1.45 | 1.37 | 1.45 | 1.43 | 1.41 | 1.47 | [16] |
Сольваты C60 с моно- и дигалогенбензолами
По спектроскопическим и термохимическим данным [211,212], кристаллы I-IV состоят из электронейтральных молекул, соединённых невалентными взаимодействиями. Моноклинный сольват I содержит несколько искажённые гексагональные слои фуллереновых сфер, между которыми в тригонально-призматических пустотах располагаются молекулы C6H5Br. Молекулы бромбензола расположены на плоскостях симметрии перпендикулярно к ним, а молекулы фуллерена — в позициях симметрии 2/m. Межцентровые расстояния молекул фуллерена в слое равны 10.16 Å (2 соседние молекулы) и 10.00 Å (4 соседние молекулы), кратчайшие расстояния между центрами C60, расположенных в соседних слоях — 11.34 Å. Таким образом, МКЧ=6 (здесь и далее при описании мотива (C60)n под МКЧ подразумевается число молекул фуллерена, соседствующих с данной). Аналогичный фуллереновый мотив с точной гексагональной симметрией встречается в ранее изученных сольватах состава C60·2A (где A — растворитель), с CCl4, хлороформом, бромоформом [83] и молекулярном комплексе с белым фосфором P4 [80], однако во всех этих веществах расстояние между слоями меньше, и имеются ван-дер-ваальсовы контакты между молекулами фуллерена из разных слоёв. Мотив плотных гексагональных слоёв с молекулами гостя в пустотах был также найден ранее в ряде других молекулярных комплексов бакминстерфуллерена — например, в C60·2Cp2Fe [213] и C60·1.33(S4N4)·0.67(C6H6) [214]. Параметр разбавления ρ для I и II (см. Табл. 6) равен 0.80 и 0.82 соответственно, т.е. находится в интервале значений, обычном для комплексов 1:2 указанного типа [79].
Молекула растворителя в сольвате I, как и в других сольватах, имеет обычную геометрию (длины связей C-C в C6H5Br 1.38–1.39 Å, C-Br 1.91 Å). Молекула фуллерена разупорядочена между двумя ориентациями с соотношением заселённостей (по результатам уточнения) 25:75. Взаимное расположение ориентаций соответствует типу (а) на Рис. 15 (см. Литературный обзор), т.е. ориентации связаны поворотом на 90o вокруг оси симметрии второго порядка молекулы. В преобладающей ориентации молекулы C60 ориентированы друг относительно друга так, что кратчайшие межмолекулярные контакты CC (3.22 Å) образуются между парами атомов, соединённых связями 6/6 (Рис. 31а). Во второй ориентации взаимное расположение молекул аналогично, C Å. Контактирующие связи 6/6 разных ориентаций перпендикулярны друг другу. Ориентация упорядоченной молекулы растворителя в полости такова, что атом брома направлен на один из разупорядоченных атомов углерода, принадлежащий к менее заселённой ориентации. Кратчайшее расстояние Br···C(фуллерен) составляет 3.23 Å, более дальние контакты Br···C — 2 по 3.67 Å с участием атомов преимущественной ориентации той же молекулы фуллерена, образующих связь 6/6, и 2 по 3.65 Å с участием упорядоченных атомов двух других соседних молекул фуллерена. Кратчайшие межмолекулярные контакты C···Br в фуллереновых структурах, описанных в литературе, наблюдаются в σ-производном C60C(C6H4Br)2 и составляют 3.45 Å [215]. Стекинг-взаимодействие между ароматическим кольцом молекулы растворителя и молекулой фуллерена отсутствует в обеих ориентациях.
Упорядоченный иодобензольный сольват II с аналогичным составом 1:2 имеет такую же упаковку молекул, что и I, однако вдвое больший объём ячейки. Соотношение элементарных ячеек сольватов I и II показано на Рис. 29. Молекулы фуллерена в II расположены в центрах инверсии, а молекулы растворителя — в общих позициях. Кратчайшие межцентровые расстояния фуллерен-фуллерен в II сокращены по сравнению с I и составляют 9.89 Å (2 соседа), другие расстояния между молекулами фуллерена в слое равны 10.02 Å (4 соседа), а кратчайшие расстояния между молекулами из соседних слоёв увеличены до 11.72 Å ввиду большего размера молекулы растворителя. Взаимная ориентация наиболее тесной пары молекул фуллерена отклоняется от C2v-симметричного расположения, при котором молекулы ориентированы друг к другу двойными связями 6/6. Поэтому, несмотря на уменьшение межцентровых расстояний C60-C60 в II, кратчайшие расстояния C···C в нём остаются практически такими же, как в I: 3.24 Å (Рис. 31б). Кратчайшее расстояние C···I составляет 3.31 Å, следующие расстояния — 3 по 3.68 Å с атомами той же и двух других молекул фуллерена. Значения кратчайших контактов C···I в иодсодержащих молекулярных комплексах фуллерена, описанных в литературе, равны 3.29 Å для C60·C6H6·CH2I2 [216] и 3.29 Å для C60·C6H5CH3·I2 [126].
В моноклинном сольвате III с несколько более крупными молекулами C6H4Br2, также имеющем состав 1:2, не имеется плотных гексагональных слоёв (C60)n. Молекулы фуллерена образуют кладку, близкую к простой кубической (расстояния между центрами C60 составляют 9.87–10.08 Å), а молекулы растворителя попарно располагаются в пустотах (Рис. 32). Вся структура упорядочена. Фуллерен занимает частную позицию симметрии 2/m, а растворитель — частную позицию симметрии m (плоскость молекулы перпендикулярна плоскости симметрии). Ближайшие расстояния C···C (фуллерен···фуллерен) отвечают обычным ван-дер-ваальсовым контактам ( ≥ 3.30 Å). В то же время каждая пара молекул растворителя в одной полости фуллеренового каркаса объединена двумя контактами Br···Br длиной 3.88 Å, а также связана с другими молекулами растворителя контактами Br···Br, сокращёнными до 3.41 Å (удвоенный ван-дер-ваальсов радиус Br равен 3.70 [217]; по другим данным, расстояния до 3.79 Å свидетельствуют о специфическом взаимодействии [218]). Вероятно, данные сокращённые контакты соответствуют вторичным связывающим взаимодействиям, ответственным за упорядочение структуры. Несмотря на это, контакты C···C (фуллерен-растворитель) имеют обычные длины ≥ 3.32 Å. Полная упорядоченность структур II и III при наличии тяжёлых атомов обусловливает высокую точность их определения (см. Табл. 6).
| Таблица 9. Параметры ячеек изоморфных гексагональных сольватов по данным порошковой рентгенографии [212] |
||
|---|---|---|
| Состав | a, Å | c, Å |
| C60·2/3м-C6H4Me2 | 23.85(2) | 10.11(1) |
| C60·2/3C6H3Me3 | 23.8098(9) | 10.130(1) |
| C60·2/3м-C6H4Cl2 | 23.742(1) | 10.167(1) |
| C60·2/3м-C6H4Br2 | 23.786(7) | 10.15(2) |
По данным ДСК и порошковой рентгенографии, в системе C60-м-дибромбензол существует другой сольват, стабильный выше 336 K [211]. Он имеет состав C60·2/3(m-C6H4Br2) и изоморфен известному сольвату с м-ксилолом (см. Табл. 9). Последний описан в оригинальной работе как имеющий состав 1:2 [82]. Упаковка молекул фуллерена в этом сольвате представляет собой трёхмерный каркас (МКЧ=10) с каналами. Однако нереалистически короткие межмолекулярные контакты ( ≥ 2.2 Å) и аномально высокое значение коэффициента упаковки (0.94), рассчитанные нами по атомным координатам из [82], указывают на вероятную ошибку в цитированном структурном исследовании, связанную с разупорядоченностью молекул растворителя.
Моноклинный сольват бакминстерфуллерена с орто-дибромбензолом IV имеет состав 1:3 и содержит искажённый алмазоподобный каркас молекул фуллерена, в пустотах которого находятся молекулы растворителя (Рис. 33). Одна молекула фуллерена и три симметрически независимые молекулы растворителя занимают общие позиции. Параметр разбавления ρ в IV равен 1.22, что меньше его значения для идеальной алмазной решётки (1.94). Кратчайшие межцентровые расстояния (10.01–10.14 Å) сопровождаются ван-дер-ваальсовыми контактами C···C длиной 3.27–3.50 Å. Две из трёх молекул растворителя разупорядочены между двумя ориентациями с заселённостями 80:20. Третья молекула растворителя, а также молекула фуллерена упорядочены. Контакты Br···Br, сокращённые до 3.50 Å, объединяют все три независимые молекулы растворителя в зигзагообразные цепочки.
Таким образом, в зависимости от природы растворителя могут образовываться сольваты C60 с разным составом и различной плотностью упаковки молекул фуллерена. Большее содержание растворителя соответствует более разреженным мотивам (C60)n. Сокращённые межмолекулярные контакты в большинстве случаев коррелируют с лучшим упорядочением кристаллической структуры, которое, в свою очередь, улучшает точность структурного исследования.
Комплексы с ароматическими молекулами
К настоящему времени исследовано значительное количество комплексов фуллеренов с углеводородами, содержащими несколько ароматических циклов. Так, известны комплексы C60 с диантраценом [101], триптиценом и азатриптиценом [219], в которых ароматические молекулы плотно прилегают к фуллереновому сфероиду, а также с тетрафенилэтиленом и 9,10-дифенилантраценом [220]. Комплексы фуллеренов с твёрдыми углеводородами, не содержащие растворителя, термически устойчивы и поэтому являются перспективными объектами для интеркаляции щелочных металлов. Селективное образование устойчивого диантраценового комплекса с C60 может использоваться для его отделения от C70 [101].
Нами были исследованы комплексы C60 с 1,3,5-трифенилбензолом (TPB). В зависимости от использованного растворителя, этот донор образует два различных комплекса. При выращивании кристаллов из раствора C60 и TPB в бензоле был получен моноклинный комплекс V состава 1:1, не содержащий растворителя. Молекулы фуллерена и донора в V расположены в общих позициях. C60 разупорядочен по типу (б) (т.е. поворотом на 60o вокруг оси 3 молекулы, см. Рис. 15) с заселённостями ориентаций 77% и 23%.
Фуллереновые молекулы образуют гофрированные слои, перпендикулярные оси a. Каждая молекула имеет 5 соседей на межцентровых расстояниях 9.856 (×2), 10.023 (×2) и 10.085 Å. Кратчайшие расстояния C···C в данных контактах составляют 3.26 и 3.21 Å. Молекулы из разных слоёв удалены друг от друга (кратчайшее межцентровое расстояние — 13.12 Å), т.к. фуллереновые слои разделены гофрированными слоями TPB (Рис. 34). Атомы углерода фенильных колец TPB образуют ван-дер-ваальсовы контакты с молекулой C60 на расстояниях C···C 3.21–3.51 Å, причём кратчайшие из них образованы с участием упорядоченных атомов фуллеренового каркаса. Фенильные группы TPB повёрнуты по отношению к центральному кольцу, образуя с ним двугранные углы 35.6, 38.8 и 40.2o. В чистом TPB данные углы лежат практически в том же диапазоне (35.3–39.8o) [221].
При выращивании кристаллов из хлорбензола образуется другое соединение — сольват VI молекулярного комплекса состава 1:2. В его структуре упорядоченная молекула фуллерена расположена в центре инверсии, упорядоченная молекула TPB — в общей позиции, а молекула хлорбензола разупорядочена между двумя ориентациями, связанными центром инверсии. Сильное увеличение параметра разбавления в VI (2.11, см Табл. 6) по сравнению с V (1.07) сопровождается переходом от гофрированного слоистого к колоночному мотиву расположения C60.
Молекулы бакминстерфуллерена в VI образуют колонки, направленные вдоль оси a и разделённые попарно расположенными молекулами TPB (Рис. 35). Две молекулы TPB в паре соединены центром инверсии, так что их центральные кольца параллельны (Рис. 36). Молекула TPB имеет обычную форму пропеллера с углами наклона фенильных групп 43.9, 40.7 и 46.6o, что немного больше значений для чистого донора (см. выше). Расстояния C···C между атомами центральных колец составляют 3.68–3.70 Å. Контакты C···C с участием фенильных групп TPB лежат в интервале 3.320–3.520 Å. Длины связей в TPB в обоих соединениях (V и VI) лежат в тех же интервалах, что и в индивидуальном веществе (1.38–1.40 Å для ароматических связей C-C и 1.48–1.49 Å для одинарных). Каждая из упорядоченных молекул фуллерена в VI имеет двух ближайших соседей в колонке на межцентровом расстоянии, равном параметру ячейки (10.09 Å). Кратчайшие контакты фуллерен···фуллерен имеют длину 3.42 и 3.45 Å и образованы парой атомов, соединённых связью типа 5/6.
Отсутствие укороченных межмолекулярных контактов и искажений молекулярной геометрии в V и VI указывает на обычную ван-дер-ваальсову природу этих молекулярных комплексов. Данные ИК- и УФ-спектроскопии, полученные Р. Н. Любовской и соавторами, подтверждают, что комплексы V и VI обладают нейтральным основным состоянием, т.к. в их спектрах присутствуют несмещённые линии, характерные для индивидуальных фаз фуллерена и донора.
В отличие от I-VI, колебательные спектры которых представляют собой наложение полос их индивидуальных компонент, в ИК-спектре соединения VII характеристическая колебательная полоса C60, частота которой коррелирует с зарядом углеродного остова, сдвинута с 1429 см-1 до 1396 см-1. В ЭПР-спектре VII присутствует интенсивный широкий сигнал с g=2.00006, что также свидетельствует о переносе электрона и образовании анион-радикала C60- (спектроскопические данные были получены Д. В. Конаревым и соавторами в Университете Киото, Япония). Ион-радикальная соль VII кристаллизуется в тетрагональной сингонии. Разупорядоченные анионы фуллерена и катионы ТDAE расположены в частных позициях симметрии 4/m, а упорядоченные нейтральные молекулы TBPD — в частных позициях 2/m. Геометрические параметры молекул TBPD и TDAE показаны на Рис. 38 и сопоставлены с соответствующими величинами для реперных соединений в Табл. 10.
Анион-радикалы C60- в VII изолированы друг от друга и уложены в разреженные квадратные слои. Кратчайшие расстояния между центрами равны параметру ячейки (13.63 Å). Катионы TDAE+ расположены в центрах квадратов, а упорядоченные молекулы TBPD попарно разделяют фуллереновые сферы (см. Рис. 37). Межслоевое пространство заполнено фенильными группами молекул TBPD, образующими между собой контакты C···C длиной 3.63–3.72 Å.
| Таблица 10. Геометрические параметры молекул TBPD и TDAE в VII |
|||||
|---|---|---|---|---|---|
| Тетракис(диметиламино)этилен (TDAE) | |||||
| Связь | a | b | c | Торс. угол | Ссылка |
| C60·2TBPD·TDAE | 1.24(2) | 1.32(2) | 1.57(2) | 90 | VII |
| TDAE | 1.350 | 1.418 | 1.439 | 25.5 | [222] |
| TDAE2+(CF3S-)2 | 1.511 | 1.314 | 1.471 | 70.9 | [223] |
| Тетрабензилпарафенилендиамин (TBPD) | |||||
| Связь | a | b | c | d | Ссылка |
| C60·2TBPD·TDAE | 1.386(7) | 1.390(5) | 1.399(6) | 1.450(5) | VII |
| TBPD | 1.386 | 1.391 | 1.401 | 1.445 | [224] |
Ось симметрии четвёртого порядка проходит через середины двух противоположных связей 6/6 в молекуле фуллерена. Две ориентации последней, имеющие равную заселённость, переводятся друг в друга данной осью (тип «а»). Молекула TDAE также разупорядочена в соответствии с симметрией частной позиции (Рис. 39). Наблюдаемая картина может быть результатом наложения двух ориентаций плоской молекулы или двух ориентаций молекулы, скрученной под углом 90o. Однако плоская конформация невозможна ввиду коротких внутримолекулярных контактов между метильными группами (до 1.74 Å). В чистом тетракис(диметиламино)этилене молекула TDAE поэтому принимает неплоскую конформацию с торсионным углом 25o [222]. По-видимому, в VII присутствует TDAE в заторможенной конформации, с полностью разорванной π-компонентой двойной связи, что характерно для катион-радикала. Не исключено также совместное присутствие в кристалле дикатионов TDAE2+ и нейтральных молекул TDAE, однако разупорядоченность не позволяет установить геометрию молекулы с достаточной точностью, чтобы различить случаи катиона и дикатиона. Ян-теллеровские искажения геометрии аниона C60n-, отмеченные, например, в [112], также не могут быть зафиксированы из-за разупорядоченности. Молекула TBPD сохраняет свою обычную геометрию, и следовательно, не принимает участия в переносе заряда.
Комплексы с производными тетратиафульвалена
Фуллерены C60 и C70 образуют молекулярные комплексы с рядом производных тетрахалькогенафульваленов. Мотив упаковки фуллерена в этих комплексах варьируется от трёхмерных каркасов в TMTSeF·C60 ·2CS2 [92] через плоские слои в TMTSeF·C60·0.5C6H6 [225], 2(TMDTDM-TTF)·C60·3CS2 [226], BET-TTF·C60·C7H8 [227], C60·(BEDT-TTF+·I3-) [99] и одномерные цепочки в 2BEDT-TTF·C60 [93], twin-BEDT-TTF·C60·CS2 [228]7 и (2TTC1-TTF)·C60 [229] до изолированного расположения в DBTTF·C60·C6H6 [230] и BDMT-TTeF·C60·CS2 [231]. В данной работе были структурно иследованы два представителя этого класса: толуольный сольват комплекса с BNTTF (VIII) и молекулярный комплекс C60 с EDT(DET)TTF (IX). Высокое содержание C60 в обоих комплексах приводит к и плотным каркасным мотивам (C60)n с низкими значениями ρ (0.85 и 0.77, соответственно).
В структуре моноклинного комплекса VIII две кристаллографически независимые молекулы C60 (A и B на Рис. 40), а молекулы BNTTF и толуола расположены в общих позициях. Молекула растворителя разупорядочена между двумя ориентациями, связанными центром инверсии; остальная часть структуры полностью упорядочена.
Упаковка фуллеренов может быть описана как трёхмерный каркас, состоящий из искажённых гексагональных слоёв, параллельных плоскости bc (Рис. 40). Молекула C60 типа A имеет семь соседних молекул, из них шесть-в том же слое и одну в соседнем слое. Молекула типа B также контактирует с семью другими молекулами фуллерена, однако из них пять находятся в том же слое, а две — в соседнем. Межцентровые расстояния C60···C60 лежат в интервале 9.92–10.12 Å, кратчайшие контакты C···C — в интервале 3.14–3.50 Å.
Молекула BNTTF в VIII принимает конформацию «лодки». Мерой отклонения от плоской конформации могут служить двугранные углы между плоскостью центрального фрагмента S4C2 и внешними фрагментами S2C2 (Рис. 42). В данном случае эти углы равны 15.6 и 20.9o. Такая изогнутая конформация типична для производных TTF в комплексах с фуллеренами (Табл. 11). Эта тенденция обусловлена требованием возможно более плотного прилегания донорной молекулы к сферической поверхности углеродного кластера. Производные TTF без объёмистых заместителей сами по себе обычно являются плоскими. Среди более чем 300 исследованных структур производных TTF, находящихся в КБСД, наиболее типичной является плоская конформация, однако они могут принимать неплоскую конформацию при невалентных контактах с объёмными молекулами или молекулярными фрагментами. Так, например, в индивидуальном TTM-TTF [232] φ1=φ2=24.7o.
Ван-дер-ваальсовы контакты BNTTF-C60 имеют длины 3.20–3.40 Å (C···C) и 3.46–3.60 Å (C···S), т.е. равны или немного короче суммы ван-дер-ваальсовых радиусов (3.40 и 3.50 соответственно [217]). Молекулы толуола находятся в полостях упаковки; их кратчайшие контакты C···C с молекулой фуллерена составляют 3.64 Å.
Моноклинный комплекс IX не содержит растворителя. Две кристаллографически независимые молекулы C60 и одна молекула EDT(DET)TTF занимают общие позиции. Одна из независимых молекул C60 (A) упорядочена, в то время как другая (B) разупорядочена. Описать разупорядоченность в виде одного из стандартных типов (см. Рис. 15) не удалось; молекула аппроксимирована наложением двух ориентаций, не имеющих общих атомов.
Мотив упаковки фуллерена в IX может быть описан как трёхмерный каркас, пронизанный каналами в направлении a (Рис. 41). МКЧ фуллерена равно 7 для молекул типа A и 6 — для B. Межцентровые расстояния лежат в интервале 9.83–10.19 Å, кратчайшие контакты C···C ≥ 3.09 Å для разупорядоченной и ≥ 3.32 Å — для упорядоченной молекул C60. Молекулы донора EDT(DET)TTF расположены в каналах и также имеют изогнутую конформацию (φi=13.9, 27.8o).
| Таблица 11. Геометрия замещённых тетрахалькогенафульваленов (обозн. см. Рис. 42) |
|||||||
|---|---|---|---|---|---|---|---|
| Соединение | Длины связей | Угол X-C-X | Углы φi | Ссылка | |||
| a | b | c | d | ||||
| 2C60·BNTTF·PhMe | 1.317(6) | 1.758(2) | 1.745(2) | 1.343(4) | 114.0 | 15.6, 20.9 | VIII |
| 2C60·EDT(DET)TTF | 1.36(1) | 1.744(4) | 1.760(4) | 1.337(8) | 114.8 | 13.9, 27.8 | IX |
| TMTSeF·C60·2CS2 | 1.348 | 1.890 | 1.906 | 1.333 | 112.4 | 24.4, 23.4 | [92] |
| C60·(BEDT-TTF+·I3-) | 1.393 | 1.724 | 1.749 | 1.348 | 115.4 | 6.9 | [99] |
| 2BEDT-TTF·C60 | 1.327 | 1.760 | 1.761 | 1.343 | 113.1 | 23.3, 33.6 | [93] |
| twin-BEDT-TTF·C60·CS2 | 1.329 | 1.756 | 1.757 | 1.336 | 113.8 | 5.1, 11.1, 11.3, 20.1 | [228] |
В Табл. 11 представлена геометрия молекул донора в исследованных нами и родственных комплексах. Производные TTF в исследованных нами комплексах по геометрии ближе к нейтральным молекулам, чем к катионам. Кратчайшие межмолекулярные контакты в VIII и IX указывают на обычный ван-дер-ваальсов характер взаимодействия в этих соединениях и на отсутствие в них специфического связывания. ИК- и УФ-спектроскопия также подтверждает нейтральную природу данных комплексов, т.к. в их спектрах линии исходных веществ не смещены (по данным Д. В. Конарева и соавторов). Таким образом, неплоская молекулярная геометрия производных TTF в VIII и IX, по-видимому, вызвана стерическими причинами и не связана с электронными факторами.
Комплексы с производными тетрафенилпорфирина
Молекулярные комплексы фуллеренов с порфиринами и порфиринатами металлов представляют особый интерес как потенциальные молекулярные ферромагнетики, сверхпроводники и модельные соединения для изучения фотоиндуцированного переноса электронов [78]. Природа этих соединений может варьироваться в широких пределах, от нейтральных молекулярных кристаллов до π-координированных производных, комплексов с переносом заряда и ионных солей. Фазы с привитым порфирином используются при хроматографическом разделении и очистке фуллеренов [233]. Порфиринаты металлов, образующие кристаллические молекулярные комплексы с фуллеренами (а также их эндоэдральными производными) используют для уменьшения ротационной разупорядоченности фуллеренового остова за счёт вторичного связывания металл-фуллерен (см. Литературный обзор).
Нами был исследован ряд комплексов фуллеренов C60 и C70 с тетрафенилпорфирином и порфиринатами металлов. Из смешанного бензольного раствора H2TPP и C60 Д. В. Конаревым и соавторами были закристаллизованы в одинаковых условиях два различных комплекса C60·H2TPP·nC6H6, отличающися только содержанием растворителя: n=3 (X) и n=4 (XI). Несмотря на близость состава и параметров разбавления, они сильно различаются по типу упаковки молекул («квазиполиморфны»). В [234] сообщается о третьем комплексе состава C60·TPPH2·3(C7H8), полученном в аналогичной системе с использованием другого растворителя — толуола. Он содержит более разбавленный цепочечный фуллереновый мотив (ρ = 2.56).
Ромбоэдрические кристаллы X содержат разупорядоченную молекулу фуллерена в общей позиции, молекулу порфирина в центре инверсии и три независимые молекулы бензола, одна из которых находится в общей позиции, другая — на оси 3 и третья — в позиции 3. Центральная часть макроцикла находится в «сэндвиче» из двух молекул фуллерена. Молекулы C60 образуют трёхмерные «соты» с каналами вдоль осей третьего порядка; молекулы H2TPP располагаются в стенах каналов, а их фенильные группы вместе с молекулами растворителя заполняют каналы (Рис. 43). МКЧ молекулы фуллерена равно 5, межцентровые расстояния составляют 9.81 (×2), 9.85 и 9.95 (×2) Å. Кратчайшие межфуллереновые контакты C···C равны 3.24 Å. Молекула порфирина образует с C60 контакты C···N своими атомами азота на расстояниях ≥ 3.02 Å.
В моноклинном комплексе XI молекула фуллерена и одна из независимых молекул бензола расположены в общих позициях, а молекула порфирина и две другие молекулы бензола — в центрах инверсии. Несмотря на близость состава и параметров разбавления X и XI, комплекс XI по мотиву упаковки фуллерена резко отличается от X и содержит гофрированные графитоподобные слои (Рис. 44). МКЧ фуллерена равно 3, межцентровые расстояния составляют 9.93–10.14 Å. Плоские молекулы порфирина расположены в межслоевых промежутках, причём плоскость макроцикла помещается между двумя фуллереновыми молекулами из разных слоёв (C···N ≥ 2.96 Å), находящимися на межцентровом расстоянии 12.23 Å друг от друга. Молекула фуллерена разупорядочена по типу (б) с соотношением заселённостей 65:35.
Длины связей в порфириновых фрагментах в соединениях X-XVI представлены в Табл. 13. Как видно, они близки к аналогичным величинам для чистого H2TPP и порфиринатов металлов, практически не изменяясь в зависимости от наличия металла и от окружения в кристалле. Макроцикл, как содержащий атом металла в плоскоквадратном окружении, так и не содержащий его, может принимать две конформации: плоскую и седловидную. Количественной характеристикой близости макроцикла к тому или иному типу конформации служит параметр D — среднеквадратичное отклонение атомов макроцикла от плоскости. Анализ по КБСД показывает, что как незамещенный тетрафенилпорфирин, так и его комплексы с медью и цинком в индивидуальной форме образуют упаковку с седловидной конформацией, а в некоторых сольватах — с плоской. Следовательно, макроцикл является структурно нежёстким и может менять конформацию в зависимости от упаковочных взаимодействий. В XIV и XV, где окружение атома Zn достроено Py-лигандом до уплощённой тетрагональной пирамиды (расстояние Zn-N равно 2.151(4) Å в XIV и 2.133(6) Å в XV, т.е. соответствует ковалентной связи), атом Zn выступает из среднеквадратичной плоскости атомов порфиринового макроцикла на 0.435 и 0.433 Å, соответственно, а сам макроцикл в этих структурах несколько отклоняется от планарности в сторону конусовидной геометрии (см. Табл. 13).
Для контактов атома металла со сферической молекулой фуллерена более выгодна плоская конформация TPP. В соответствии с этим, комплекс XII, содержащий седловидные металлопорфириновые молекулы, а также комплексы XIV и XV, в которых атом металла выдвинут из плоскости макроцикла ввиду координации апикальным пиридиновым лигандом, обнаруживают обычные ван-дер-ваальсовы расстояния металл···фуллерен наряду с разупорядоченностью фуллеренового остова. В отличие от них, комплекс XIII содержит плоский макроцикл и сближенный с ним упорядоченный фуллереновый фрагмент.
В моноклинном комплексе бакминстерфуллерена XII, не содержащем растворителя, молекула CuTPP расположена в общей позиции, а молекула фуллерена — на оси второго порядка, проходящей через центр молекулы и середины двух противоположных связей типа 5/6. Таким образом, молекула C60 разупорядочена между двумя ориентациями, связанными осью 2 (Рис. 15а).
Молекулы фуллерена собраны в колонки, параллельные оси c. Каждая молекула имеет двух ближайших соседей на расстоянии 9.92 Å; контакты C···C составляют 3.10–3.40 Å. Молекулы донора, имеющие неплоскую седловидную конформацию, попарно располагаются в пустотах. Кратчайшие контакты C···N с участием атомов фуллерена составляют 3.36 Å, C···Cu-3.28 Å, что соответствует обычным ван-дер-ваальсовым взаимодействиям. По общему мотиву упаковки данное соединение аналогично известной серии изоморфных комплексов с октаэтилпорфиринатами двухвалентных металлов MOEP·C60·C6H6·CHCl3 [91], в которых, однако, макроцикл имеет планарную конформацию.
В структуре XIII упорядоченная молекула C70 расположена в общей позиции, а две симметрически независимые молекулы CuTPP — в центрах инверсии. Одна молекула толуола расположена в общей позиции, другая — в центре инверсии; обе разупорядочены. Кроме того, в кристалле присутствует нестехиометрическое количество трихлорэтилена, молекула которого расположена в общей позиции и разупорядочена между тремя ориентациями с суммарной заселённостью около 0.5. Фенильные группы молекул CuTPP разупорядочены между двумя ориентациями, отличающиеся торсионными углами по отношению к плоскости макроцикла. Геометрия упорядоченной молекулы C70 при этом определена с хорошей точностью (см. Табл. 8).
| Таблица 12. Серии «квазиизоморфных» комплексов фуллерен/порфирин |
|||||||
|---|---|---|---|---|---|---|---|
| Формула | a, b, c (Å) | α, β, γ (o) | V, Å3 | Пр. гр. | Z | k | ρ |
| H2TPP·2C60·4C6H6 (XI) | 13.7422(6), 20.765(1), 18.626(1) | 90, 91.814(4), 90 | 5312 | P21/c | 4 | 0.74 | 1.43 |
| CoTMPP·2C60·3C7H8 * (КБСД) | 13.984(1), 21.388(2), 18.178(2) | 90, 96.586(2), 90 | 5401 | P21/c | 4 | 0.75 | 1.58 |
| H2TPP·C60·3C7H8 (КБСД) | 14.2783(3), 16.7220(3), 17.0596(3) | 69.115(1), 85.338(1), 78.164(1) | 3725 | P1 | 2 | 0.76 | 2.56 |
| CuTPP·C70·1.5C7H8·0.5C2HCl3 (XIII) | 14.3756(6), 16.5497(8), 17.6590(9) | 72.460(1), 86.278(1), 80.577(1) | 3951 | P1 | 2 | 0.71 | 2.15 |
| ZnTPP·C70[234] | 14.4805(1), 16.5025(2), 17.7287(3) | 72.623(1), 86.580(1), 80.574(1) | 3988 | P1 | 2 | 0.61 | 2.18 |
| 2PyCoTPP·C60·Cp2Fe·C7H8 (КБСД) | 30.5233(4), 19.5925(2), 19.2515(2) | 90, 92.067(1), 90 | 11505 | C2/c | 4 | 0.73 | 4.50 |
| (PyZnTPP)2C60·Cp2Fe·C7H8 (XIV) | 30.797(2), 19.532(2), 19.312(1) | 90, 91.861(2), 90 | 11611 | C2/c | 4 | 0.72 | 4.55 |
| (PyZnTPP)2C70·C7H8·0.5C2HCl3 (XV) | 30.763(3), 19.825(2), 20.036(2) | 90, 92.250(2), 90 | 12210 | C2/c | 4 | 0.69 | 3.86 |
| * CoTMPP — тетракис(метоксифенил)порфиринат кобальта | |||||||
Мотив упаковки молекул фуллерена представляет собой зигзагообразные цепочки с МКЧ=2 и контактами C···C 3.20–3.40 Å. Каждая молекула CuTPP находится между двумя молекулами фуллерена, которые образуют с ней короткие контакты атомами углерода, находящимися при связи типа 'g' (см. Рис. 48). Две пары атомов углерода дополняют координационный полиэдр атома меди до вытянутого октаэдра (C···Cu = 2.88–3.03 Å). Каждая молекула C70 координирована двумя молекулами CuTPP посредством двух связей типа 'g', принадлежащих к одной и той же полусфере. Плоскости макроциклов образуют между собой угол в 39o и почти параллельны длинной оси молекулы фуллерена (образуют с ней углы 8 и 10o).
По параметрам ячейки и расположению в ней молекул фуллерена и порфирина соединение XIII практически идентично описанному в литературе комплексу C70·ZnTPP [234]. Однако в структуре последнего не отмечено присутствия растворителя. Близость параметров, высокий R-фактор данной структуры и её аномально низкий коэффициент упаковки (k=0.61), по-видимому, свидетельствуют о наличии сольватных молекул, не выявленных в цитированной работе ввиду сильной разупорядоченности.
Выращивание кристаллов фуллеренов с тетрафенилпорфиринатами металлов в присутствии ферроцена может приводить к трёхкомпонентным комплексам. В моноклинном XIV молекулы C60, ферроцена и толуола находится в центрах инверсии, а молекула PyZnTPP — в общей позиции. Молекула фуллерена разупорядочена по типу (а)(см. Рис. 15) с соотношением заселённостей 70:30; молекула толуола разупорядочена по двум ориентациям, связанным центром инверсии. Каждая молекула фуллерена окружена двумя порфириновыми фрагментами и изолирована ими от других молекул фуллерена (Рис. 49). Атом металла выдвинут из плоскости макроцикла в направлении пиридинового лиганда и не образует сокращённых контактов с атомами углеродного кластера.
Комплекс XV имеет подобную XIV элементарную ячейку и близкий состав (см. Табл. 12). По мотиву упаковки молекул он также аналогичен XIV; молекула C70 разупорядочена центром инверсии и не образует коротких контактов с атомом металла (Рис. 50). Однако различие в размерах C60 и C70 приводит в XV к уменьшению размеров полости, занятой в XIV молекулой ферроцена. Кристаллы XV, выращенные в тех же условиях, что и XIV (из смеси C6H6/C2HCl3 в присутствии ферроцена), не включают Cp2Fe в свой состав. На месте ферроцена в элементарной ячейке XV располагается разупорядоченная и частично заселённая позиция меньшей по размерам молекулы второго растворителя — трихлорэтилена.
| Таблица 13. Геометрические параметры порфириновых циклов в исследованных соединениях в сравнении с литературными данными. Обозначения связей см. Рис. 51. |
||||||||
|---|---|---|---|---|---|---|---|---|
| Формула | Усреднённые длины связей | D | Ссылка | |||||
| a | b | c | d | e | f | |||
| 2C60·H2TPP·3C6H6 (X ) | 1.378 | 1.439 | 1.353 | 1.405 | 1.510 | - | 0.053 | [210] |
| 2C60·H2TPP·4C6H6 (XI) | 1.376 | 1.443 | 1.358 | 1.405 | 1.501 | - | 0.042 | [210] |
| H2TPP | 1.350 | 1.438 | 1.361 | 1.403 | 1.514 | - | 0.189 | [235] |
| H2TPP·2o-C6H4Me2 | 1.377 | 1.443 | 1.354 | 1.391 | 1.515 | - | 0.010 | [236] |
| H4TPP(ClO4)2·C6H6 | 1.390 | 1.431 | 1.365 | 1.414 | 1.491 | - | 0.417 | [237] |
| C60·2CuTPP (XII) | 1.378 | 1.442 | 1.355 | 1.396 | 1.498 | 1.983 | 0.263 | [210] |
| C70·CuTPP·1.5C6H5Me·0.5C2HCl3 (XIII) | 1.384 1.376 | 1.440 1.440 | 1.358 1.358 | 1.393 1.397 | 1.491 1.503 | 2.001 2.009 | 0.014 0.025 | [210] |
| CuTPP | 1.383 | 1.447 | 1.337 | 1.368 | 1.489 | 1.980 | 0.214 | [238] |
| CuTPP·2o-C6H4Me2 | 1.381 | 1.435 | 1.351 | 1.391 | 1.500 | 1.997 | 0.008 | [239] |
| C60·2PyZnTPP·C6H5Me·Cp2Fe (XIV) | 1.377 | 1.446 | 1.351 | 1.401 | 1.495 | 2.070 | 0.090 | [240] |
| C70·2PyZnTPP·C6H5Me·0.5C2HCl3 (XV) | 1.370 | 1.440 | 1.349 | 1.410 | 1.506 | 2.075 | 0.088 | [240] |
| C60Cs·CoTPP·1.7PhCN·0.3(o-C6H4Cl2)·CH3CN (XVI) | 1.375 1.372 | 1.437 1.443 | 1.343 1.351 | 1.388 1.388 | 1.491 1.486 | 1.968 1.972 | 0.016 0.016 | |
Ион-радикальная соль XVI содержит анионы C60-, катионы Cs+, а также молекулы CoTPP, бензонитрила, ацетонитрила и о-дихлорбензола. Две независимые молекулы CoTPP расположены в центрах инверсии, остальные фрагменты — в общих позициях. Структура состоит из стопок, в которых чередуются фуллерен и порфирин. Как и в XIII, каждая молекула фуллерена образует короткие контакты C···Co (2.55–2.78 Å) с двумя порфириновыми остовами. Несмотря на них, анион C60- остается разупорядоченным по двум ориентациям, наложенным друг на друга по типу (а) с соотношением заселённостей 52:48. Обе молекулы бензонитрила частично (на 12% и 18% соответственно) статистически замещены молекулами орто-дихлорбензола. Один фенильный заместитель в одной из молекул CoTPP также разупорядочен. Угол между плоскостями макроциклов, сближенных с анион-радикалом C60-, равен 63.8o.
Катион цезия расположен в пустоте упаковки, находясь в типичном для него нерегулярном окружении. В координационную сферу атома Cs (Рис. 53) входят: атомы азота двух разупорядоченных молекул бензонитрила и одной молекулы ацетонитрила, шесть атомов углерода одного из анионов фуллерена, образующих шестичленный цикл (главная ориентация), два атома углерода другого аниона фуллерена, образующие связь типа 5/6, а также четыре атома углерода, принадлежащих молекуле CoTPP. Общее координационное число Cs по атомам С и N составляет 15, расстояния Cs···N равны 3.05–3.21 Å, Cs···C — 3.43–3.86 Å. В известных соединениях цезия (КБСД), где катион Cs+ координирован только атомами C и N, КЧ составляет 14–19, расстояния Cs···N 3.07–3.30 Å, Cs···C 3.44–3.90 Å. В структуре Cs6C60 [37] присутствует координационная сфера, сформированная исключительно из атомов C, которая включает 22 атома на расстояниях Cs···C 3.37–3.69 Å.
В ион-радикальных солях фуллерена, описанных в литературе, поведение фуллерид-аниона варьирует от полной разупорядоченности (например, Cp2Co+·C60-·CS2 [241]) до полностью упорядоченного полимера с ковалентно связанными фуллереновыми фрагментами (например, Tol2Cr+·C60-·CS2 [73]). Фуллерид-анионы в XVI характеризуются островным расположением с МКЧ=1. Два аниона, образующие «остров», находятся на межцентровом расстоянии 9.88 Å друг от друга, а контакты C···C между ними составляют 3.07–3.48 Å. Таким образом, в соответствии с литературными данными (см. § 2.5). межцентровые и кратчайшие межатомные расстояния в паре (C60-)2 немного сокращены по сравнению с ван-дер-ваальсовыми комплексами из незаряженных молекул благодаря электростатическому притяжению Cs···C60. Наличие электростатических взаимодействий, однако, не приводит к существенной модификации общего характера ван-дер-ваальсовых сил упаковки — в частности, в XVI сохраняется ротационная разупорядоченность C60-. Отметим, что величины коэффициента упаковки k=0.76 для обеих исследованных нами ион-радикальных солей VII и XVI находятся в середине интервала значений 0.70–0.81, характерного для остальных комплексов, составивших предмет настоящей работы (Табл. 6).
В настоящей главе приведены кристаллографические данные исследованных соединений, параметры рентгеновских экспериментов и детали расшифровки и уточнения структур.
Кристаллы сольватов I–IV предоставлены М. В. Коробовым и Е. Б. Стукалиным (Химический факультет МГУ, лаб. термохимии). Молекулярные комплексы V и VI получены А. Л. Литвиновым и Р. Н. Любовской, XII–XV — Д. В. Конаревым и Р. Н. Любовской в Институте Проблем Химической Физики РАН (Черноголовка), комплексы VIII, IX, VII и XVI - Д. В. Конаревым и G. Saito в Kyoto University (Япония).
Сольваты и молекулярные комплексы, содержащие растворитель, способны выветриваться на воздухе, тогда как молекулярные комплексы, не включающие растворителя, устойчивы на воздухе в течение долгого времени. Выращенные кристаллы V, IX и VII хранили на воздухе в сухом виде, а кристаллы всех остальных соединений (включая XII, отсутствие растворителя в котором не было доказано до рентгеноструктурного исследования) переносили на дифрактометр непосредственно из маточного раствора.
Состав сольватов I-IV, помимо РСА, доказан методом дифференциальной сканирующей калориметрии (М. В. Коробов, Е. Б. Стукалин). Молекулярные комплексы VIII-XVI исследованы (Д. В. Конарев) методами ИК- и УФ-спектроскопии, что позволило установить наличие в них как фуллерена, так и «гостя». Комплекс XI охарактеризован также методом рентгенофотоэлектронной спектроскопии. Большинство исследованных молекулярных комплексов было охарактеризовано соавторами методом элементного анализа. Состав соединения XV определен из уточнения кристаллической структуры (см. далее). Содержание Cs и Co в ион-радикальной соли XVI определил К. В. Золотарёв (Институт ядерной физики СО РАН, Новосибирск) методом рентгенофлуоресцентного анализа на синхротронном излучении.
Дифракционные данные для X и XI были получены в лаборатории кристаллографии университета г. Дарем (Великобритания), для всех остальных соединений — в Центре рентгеноструктурных исследований ИНЭОС РАН. Применялись четырёхкружный дифрактометр Siemens P3 (I) и дифрактометры SMART CCD 1K с двухкоординатным детектором (все остальные соединения). Отбор и предварительную оценку качества кристаллов осуществляли непосредственно на приборе перед началом съёмки. Все исследования проводили при охлаждении монокристалла в тока азота. Во всех экспериментах использовалось излучение Mo Kα, выделенное графитовым монохроматором. Сбор данных I на четырёхкружном дифрактометре проводился в режиме θ/2θ-сканирования, а на дифрактометрах SMART — методом ω-сканирования обратного пространства с шагом 0.3o по ω. Расшифровка и уточнение структуры I были выполнены Э. Ф. Валеевым, все остальные структуры определены автором настоящей работы.
Данные, полученные на приборах с двухкоординатным детектором SMART, были обработаны программой предварительной подготовки (Bruker SAINT). Во всех структурах, кроме VI, V, X и XI, были введены неэмпирические поправки на поглощение, рассчитанные по расходимости эквивалентных отражений с помощью программы SADABS [242].
Параметры элементарных ячеек и характеристики рентгеноструктурных
исследований I-XVI представлены в Табл. 14. Все
структуры были расшифрованы прямыми методами с дальнейшим уточнением методом
наименьших квадратов (МНК).
Атомы, не найденные в исходном фурье-синтезе, были локализованы из серии
разностных синтезов электронной плотности. Уточнение структур VIII и
IX ввиду большого числа параметров проводили блок-диагональным МНК, а остальных
структур — полноматричным МНК по F2 с помощью стандартного комплекса программ SHELXTL [243].
Минимизировался взвешенный R-фактор:
|
|
Все атомы водорода в структуре III были выявлены объективно из разностного синтеза электронной плотности и включены в уточнение с изотропными тепловыми параметрами. В остальных структурах разностный синтез позволил найти только часть атомов водорода, а недостающие атомы были помещены в геометрически рассчитанные позиции и уточнены по модели «наездника». Все неводородные атомы, кроме атомов разупорядоченных фрагментов, были уточнены в анизотропном приближении.
Структуры II, III и VIII полностью упорядочены; в структурах VI, IV, X, XIII, XV, XIV и XVI присутствует разупорядоченность молекул растворителя, в XIII разупорядочены фенильные группы молекулы TPP, в VII — катион-радикал TDAE+. В структурах I, V, VII, IX–XII и XIV–XVI обнаружена ротационная разупорядоченность фуллеренового остова. В случаях I, VII, XII и XIV молекула фуллерена C60 разупорядочена по типу наложения двух ориентаций, связанных поворотом на 90o вокруг оси симметрии второго порядка, что приводит к образованию шести «крестов» частично заселенных атомных позиций на поверхности молекулы (см. Литературный обзор, Рис. 15а). В структурах V и XI наложение ориентаций происходит по второму описанному в литературе типу (Рис. 15б) с поворотом на 60o вокруг оси симметрии третьего порядка, причём у молекулы фуллерена образуется разупорядоченный «пояс» из частично заселённых атомных позиций и упорядоченные «полюса». В IX и XV молекула фуллерена аппроксимирована произвольным наложением двух ориентаций (см. Обсуждение результатов). В структурах X и XVI, где тип разупорядоченности выявить не удалось, молекула фуллерена аппроксимирована одной ориентацией углеродного каркаса с сильно искажённой геометрией.
Значения заселенности ориентаций молекул фуллерена в V, IX, XI и XIV получены путём свободного уточнения данной величины с фиксированными дебаевскими параметрами. На окончательных стадиях уточнения заселенности фиксировали на полученных значениях, а дебаевские параметры варьировались. В XII, XV и VII разупорядоченные ориентации связаны кристаллографическими элементами симметрии, вследствие чего их заселенности равны 1/2. В I заселенности выбраны исходя из соотношения дебаевских параметров, установившегося на начальном этапе уточнения.
Уточнение структур V, IX, XV и XVI проводилось с ограничениями, сохраняющими геометрию разупорядоченной молекулы фуллерена (связи, эквивалентные в рамках собственной симметрии молекулы, были выровнены по длине), а в структурах VI, XIV, XV и XVI была зафиксирована правильная шестиугольная геометрия бензольного кольца в разупорядоченных молекулах растворителя.
Состав соединения XV установлен в ходе структурного исследования путём уточнения заселенности молекулы трихлорэтилена.
Автор выражает глубокую благодарность своему научному руководителю Юрию Леонидовичу Словохотову за профессионализм и настойчивость. Автор искренне признателен профессору Михаилу Вальерьевичу Коробову, Евгению Стукалину (Химический факультет МГУ), профессору Римме Николаевне Любовской, к.х.н. Дмитрию Валентиновичу Конареву, Алексею Литвинову (ИПХФ РАН, Черноголовка) и другим соавторам-химикам за предоставление молекулярных комплексов фуллеренов для РСА и исследование их другими методами, а также за плодотворные дискуссии.
Автор благодарит чл.-корр. РАН Михаила Ювенальевича Антипина (ИНЭОС РАН) и профессора Judith A. K. Howard (University of Durham, UK) за предоставление доступа к дифрактометрическому оборудованию и КБСД. При съёмке порошковых дифрактограмм на синхротронном излучении в СЦСИ большую помощь оказали к.х.н. А. И. Анчаров и к.х.н. Б. П. Толочко (ИЯФ СО РАН).
Автор выражает благодарность к.х.н. Андрею Степановичу Бацанову, к.х.н. Дмитрию Сергеевичу Юфиту (University of Durham, UK), к.х.н. Фёдору Михайловичу Долгушину и к.х.н. Константину Александровичу Лысенко (ИНЭОС РАН) за помощь в освоении кристаллографического программного обеспечения, а также Андрею Чеснокову (ВМК МГУ) за консультации по поводу системы LATEX.
Настоящая работа выполнена при поддержке Российского фонда фундаментальных исследований (гранты 99-03-32810, 00-03-06345, 02-03-33225, 02-03-06419) и программы 'Фуллерены и атомные кластеры'.